Wie bereits oft erwähnt, sind Säuren Protonendonatoren, d.h. Säuren geben H+-Ionen ab. Basen hingegen sind Protonenakzeptoren, d.h. sie nehmen H+ auf (Bronstedt-Definition). In mehreren Kapiteln auf Lernort-Mint.de wird ausführlich erläutert, warum der pH.-Wert bzw. die Einstellung eines gewünschten pH-Wertes so wichtig ist. In diesem Kapitel so kurz dargestellt werden, wie der pH-Wert gemessen werden kann. Dabei gibt es zwei wichtige Messverfahren. Die Potentiometrie als analytisches Messverfahren sowie die Verwendung von Indikatoren im Bereich der nasschemischen Messverfahren.
Mithilfe eines pH-Meters kann man den pH-Wert einer Lösung bestimmen, dabei erfolgt die Messung des pH-Werts potentiometrisch. Gemessen wird eine Spannung, die zwischen einer Bezugs- und einer Messelektrode auftritt und u.a. von der zu messenden Stoffmengenkonzentration der Oxonium-Ionen abhängt. Dabei wandelt das pH-Meter die gemessene Spannung um und am pH-Meter wird direkt der pH-Wert angezeigt. Die Messgenauigkeit moderner Geräte beträgt bis 0,01 pH-Wert-Einheiten.
Allgemein versteht man unter einem Indikatoren einen Stoff (in der Chemie), das zur Anzeigte eines Zustandes dient. Meist wird die Änderung durch eine Farbveränderung angezeigt. Die am meisten verwendeten Indikatoren in der Chemie sind die sog. pH-Indikatoren, die den pH-Wert anhand eines Vergleiches mit einer Farbskala anzeigen und den Zustand einer sauren, alkalischen oder neutralen Lösung anzeigen.
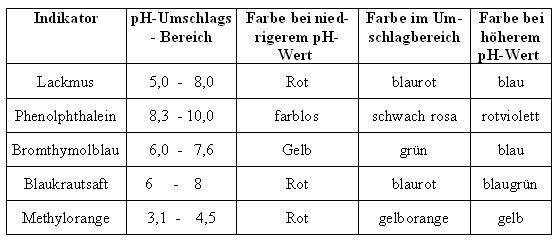
Diese pH-Indikatoren sind selbst schwache Säuren (oder Basen), das heißt sie können Protonen abgeben oder aufnehmen. Je nach Form (protonierte und deprotonierte Form) liegt eine unterschiedliche Farbe des pH-Indikators vor. Der prononierte bzw undissoziierte Indikator H-Ind absorbiert andere Lichtwellen als das Anion Ind- (deprotonierte Form). Deshalb erscheint die Lösung je nach pH-Wert unterschiedlich gefärbt. In nachfolgender Tabelle sind einige wichtige Indikatoren (wie Lackmus, Phenolphtalein oder Methylorange), sowie deren Umschlagbereich angegeben:
Achtung
Die pH-Indikatoren sind selbst schwache Säuren (oder Basen), das heißt sie können Protonen abgeben oder aufnehmen und nehmen dadurch am Reaktionsgeschehen teil und können durchaus Messwerte verfälschen. Deshalb ist darauf zu achten, dass die Konzentration von Indikatoren in der Lösung max. in der Größenordnung von 10-4 mol/l (ca. 2-3 Tropfen) vorliegt.
WEITERFÜHRENDE INFORMATIONEN auf Lernort-MINT.de
Fragen zur pH-Wert Bestimmung:
Frage1: Welche pH-Werte haben saure Lösungen?
a) pH = 7
b) pH > 7
c) pH < 7
Frage2: Saure Lösungen färben Lackmus
a) blau
b) rot
Lösung: siehe weiter unten
Lösungen: 1a und 2b
Der pH-Wert ist ein Maß für die Konzentration von Hydroniumionen (H3O+) in einer Lösung. Er dient zur Bestimmung von Säuregrad oder Basizität einer Lösung.
Die pH-Skala reicht von 0 bis 14. Ein pH-Wert unter 7 bedeutet, dass die Lösung sauer ist. Ein pH-Wert über 7 bedeutet, dass die Lösung basisch oder alkalisch ist. Ein pH-Wert von 7 zeigt eine neutrale Lösung an.
Der pH-Wert wird typischerweise mit einem pH-Meter gemessen, welches die Spannung (Potenzialdifferenz) zwischen zwei Elektroden misst und diese in einen pH-Wert umrechnet.
Die Temperatur hat Einfluss auf den pH-Wert. Bei steigender Temperatur sinkt der pH-Wert, da die Konzentration der Hydroniumionen steigt.
Eine saure Lösung hat einen pH-Wert weniger als 7 und hat eine höhere Konzentration an Hydroniumionen. Eine basische Lösung hat einen pH-Wert größer als 7 und weist eine niedrigere Konzentration an Hydroniumionen auf.
pH-Indikatoren sind Substanzen, die mit einer Farbänderung auf Änderungen des pH-Wertes reagieren und so zur visuellen Messung des pH-Wertes genutzt werden können.
Im Alltag können pH-Messungen unter anderem zur Kontrolle der Wasserqualität, beim Schwimmbadpflegen oder beim Kochen (z. B. beim Einmachen von Lebensmitteln) verwendet werden.
Pufferlösungen sind Lösungen, die in der Lage sind, ihren pH-Wert beinahe konstant zu halten, auch wenn Säuren oder Basen hinzugefügt werden.
Wenn eine Säure verdünnt wird, erhöht sich der pH-Wert, da die Konzentration der Hydroniumionen abnimmt.
Der pH-Wert und der pOH-Wert einer Lösung sind miteinander verbunden. Bei einer bestimmten Temperatur (25°C), ist die Summe von pH und pOH immer gleich 14.