Die Gasgesetze finden fachübergreifend in Chemie und Physik Anwendung und dienen dazu, dass Verhalten von Gasen bei Druck- oder Temperaturänderungen zu beschreiben. Die Gasgesetze beschreiben den Zustand des (idealen) Gases bezüglich der Zustandsgrößen Druck p, Volumen V, Temperatur T und Stoffmenge und stellen damit einen Zusammenhang zwischen diesen Größen her.
Die Gasgesetze (z.B. Gasgesetz von Boyle-Mariotte) leiten das ideale Gasgesetz bzw. das reale Gasgesetz her,mit Hilfe dessen in der Physik und Chemie alle wesentlichen Eigenschaften eines Gases bestimmt werden können. Die ideale Gasgleichung (für ideale Gase) und die Gasgleichung für reale Gase werden immer verwendet, wenn Druck, Temperatur oder Stoffmenge eines Gases bestimmt werden soll.
Die Gasgesetze (Gasgesetz von Gay-Lussac, Gasgesetz von Boyle-Mariotte und Gasgesetz von Amontons) dienen im Wesentlichen dazu, die ideale Gasgleichung herzuleiten. Jeder der genannten Wissenschaftler hat die Abhängigkeit eines Gases in Bezug auf zwei Zustandsgrößen (z.B. Temperatur und Volumen) untersucht und aus deren abgeleiteten Gesetzmäßigkeiten lässt sich das ideale Gasgesetz herleiten.
Gasgesetz von Gay-Lussac
Gay-Lussac war eine der Wissenschaftler, der sich mit dem Temperatur-Volumen-Verhalten von Gasen befasste. Dabei untersuchte Gay-Lussic die Volumenänderung eines Gases, wenn ein Gas erwärmt oder abgekühlt wurde (dabei war der Druck des Gases immer konstant). So erkannte er den Zusammenhang des Volumens eines Gases bei unterschiedlichen Temperaturen.
Bei den Experimenten beobachtete Gay-Lussac, dass Volumen proportional zur Temperatur ist bzw. umgekehrt. Wird beispielsweise die Temperatur des Gases um das Doppelte erhöht, so verdoppelt sich auch das Volumen des Gases.
Hieraus leitet sich das Gasgesetz von Gay-Lussac ab:
Das Gasgesetz von Gay-Lussac besagt, dass der Quotient aus Volumen und Temperatur einer bestimmten Menge eines Gases (bei konstantem Druck) konstant ist. Daher wird dieses Gesetz auch als Volumen-Temperatur- Gesetz bezeichnet.
Näheres zum Gasgesetz von Gay-Lussac
Gasgesetz von Boyle-Mariotte
Weitere Wissenschaftler, die sich mit dem Verhalten von Gasen beschäftigt hatten, waren Boyle und Mariotte. Dabei untersuchten sie die Druckänderung eines Gases, wenn as Volumen, in dem sich das Gas befindet (z.B. in einem Kolben) verändert wird. So untersuchten sie beispielsweise die Druckänderung, wenn das Gas in einem gefüllten Zylinder mit einem Kolben zusammengepresst wird.
Wie erwartet, beobachteten Boyle und Mariotte, dass sich das Volumen des Gases in dem Zylinder verringert (sobald sie den Kolben in den mit Gas gefüllten Zylinder drückten), während sich der Druck des Gases (indirekt) proportional vergrößert.
Hieraus leitet sich das Gasgesetz von Boyle-Mariotte ab:
Das Gasgesetz von Gay-Lussac besagt, dass der Quotient aus Volumen und Temperatur einer bestimmten Menge eines Gases (bei konstantem Druck) konstant ist. Daher wird dieses Gesetz auch als Druck-Volumen- Gesetz bezeichnet.
Gesetz von Amontons
Mit Hilfe der Gasgesetze von Gay-Lussac und Boyle-Mariotte haben wir einen Zusammenhang zwischen Temperatur und Volumen bzw. Druck und Volumen. Hätte man nun einen Zusammenhang zwischen Temperatur und Druck könnte man alle drei Zustandsgrößen eines Gases in Verbindung setzen.
Genau damit befasste sich der Wissenschaftler Amontons, der Temperatur und Druckverhalten eines Gases untersuchte. Dabei fand Amontons heraus, dass (bei konstantem Volumen eines Gases) die Temperatur und Druck zueinander proportional sind.
p1: T1 = p2 : T2
Hieraus leitet sich das Gasgesetz von Amontons ab:
Das Gasgesetz von Amontons besagt, dass der Quotient aus Druck und Temperatur einer bestimmten Menge eines Gases (bei konstantem Volumen) konstant ist. Daher wird dieses Gesetz auch als Druck-Temperatur- Gesetz bezeichnet.Das ideale Gasgesetz
Aus diesen drei Gasgesetzen lässt sich das ideale Gasgesetz herleiten. Setzt man diese drei Gasgesetze in Beziehung, so gilt für ein Gas (bei einer bestimmten Mengen) in einem abgeschlossenen System:
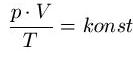
Ändert man nun in einem abgeschlossenen System eine Zustandsgröße Druck oder Volumen, ändern sich die anderen Zustandsgrößen ebenfalls, die dann über die oben genannte Beziehung berechnet werden können, das das Produkt aus Druck und Volumen geteilt durch die Temperatur konstant ist (also immer den gleichen Wert hat)
Aus diesem physikalischen Zusammenhang leitet sich die allgemeine bzw. ideale Gasgleichung her
mit
Die Gasgesetze in den Naturwissenschaften sind Gesetzmäßigkeiten, die das Verhalten von Gasen unter verschiedenen Bedingungen beschreiben. Sie umfassen das Boyle-Mariottesche Gesetz, das Charles’sche Gesetz und das Avogadro’sche Gesetz. Die allgemeine Gasgleichung verknüpft all diese Gesetze.
Das Boyle-Mariottesche Gesetz besagt, dass bei konstanter Temperatur das Produkt von Druck und Volumen eines idealen Gases konstant bleibt.
Die Formel des Boyle-Mariotteschen Gesetzes lautet P1 * V1 = P2 * V2, wobei P den Druck und V das Volumen bezeichnet.
Das Charles’sche Gesetz besagt, dass bei konstantem Druck das Volumen eines idealen Gases direkt proportional zur absoluten Temperatur ist.
Die Formel des Charles’schen Gesetzes lautet V1 / T1 = V2 / T2, wobei V das Volumen und T die absolute Temperatur bezeichnet.
Das Avogadro’sche Gesetz besagt, dass bei gleichem Druck und gleicher Temperatur gleichviele Gasteilchen das gleiche Volumen einnehmen.
Die Formel des Avogadro’schen Gesetzes lautet V1 / n1 = V2 / n2, wobei V das Volumen und n die Stoffmenge bezeichnet.
Die allgemeine Gasgleichung lautet PV = nRT, wobei P den Druck, V das Volumen, n die Stoffmenge, R die universelle Gaskonstante und T die absolute Temperatur bezeichnet.
Die ideale bzw. universelle Gaskonstante ist eine Konstante, die in der allgemeinen Gasgleichung verwendet wird. Sie hat den Wert 8,314 J/(mol*K).
Das ideale Gasgesetz basiert auf den Annahmen, dass Gasteilchen kein Eigenes Volumen haben und es keine Anziehungskräfte zwischen ihnen gibt. Diese Annahmen sind bei realen Gasen nicht immer korrekt, aber das ideale Gasgesetz gibt dennoch eine gute Annäherung an das Verhalten der meisten Gase bei mäßigen Drücken und hohen Temperaturen.