Die allgemeine Gasgleichung beschreibt den Zustand des idealen Gases bezüglich der Zustandsgrößen Druck p, Volumen V, Temperatur T und Stoffmenge und stellt damit einen Zusammenhang zwischen den Größen her.
Die allgemeine Gasgleichung gilt nur für ideale Gase, d.h. alle Teilchen eines idealen Gases werden als Massepunkte betrachtet und haben untereinander bzw. mit den Wänden des Volumens nur ideal elastische Stoßvorgänge.
Gleichung: p ·V = n ·R ·T mit
p = Druck des Gases
V = Volumen des Gases
n = Stoffmenge des Gases
R = 8,31448 J·K-1 ·mol-1
T = absolute Temperatur in Kelvin
Anwendung:
1. Mithilfe dieser Gleichung kann jeweils ein Zustand des Systems berechnet werden (sofern die anderen bekannt sind). Kennt man z.B. Volumen, Druck und Temperatur eines Gases, kann man dessen Stoffmenge n bestimmen.
2. Befindet sich ein Gas in einem abgeschlossenen System, so gilt:
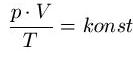
Ändert man nun in einem abgeschlossenen System eine Zustandsgröße Druck oder Volumen, ändern sich die anderen Zustandsgrößen ebenfalls, die dann über die oben genannte Beziehung berechnet werden können, das das Produkt aus Druck und Volumen geteilt durch die Temperatur konstant ist (also immer den gleichen Wert hat).
Das ideale Gasgesetz ist eine Gleichung, die den Zustand eines idealen Gases beschreibt. Es verbindet die vier Hauptvariablen: Druck (P), Volumen (V), Temperatur (T) und die Anzahl der Gasmoleküle (n). Es wird durch die Formel PV=nRT dargestellt.
Die Hauptvariablen im Gasgesetz sind Druck (P), Volumen (V), Temperatur (T) und die Anzahl der Gasmoleküle (n).
Das “R” im idealen Gasgesetz steht für die Universelle Gaskonstante.
Wenn der Druck bei konstanter Temperatur erhöht wird, verringert sich das Volumen eines idealen Gases. Dies wird durch das Boyle’sche Gesetz dargestellt.
Wenn die Temperatur bei konstantem Volumen erhöht wird, wird auch der Druck eines idealen Gases erhöht. Dies wird durch das Gay-Lussac’sche Gesetz dargestellt.
Das Charles’sche Gesetz besagt, dass das Volumen eines idealen Gases bei konstantem Druck direkt proportional zur absoluten Temperatur ist.
Wenn Das Volumen und die Temperatur konstant gehalten werden, aber die Anzahl der Gasmoleküle erhöht wird, erhöht sich auch der Druck.
Das ideale Gasgesetz kann verwendet werden, um die Masse eines Gases zu berechnen, indem zunächst die Anzahl der Moleküle berechnet wird und dann die molekulare Masse des Gases angewendet wird.
Es wird als “ideales” Gasgesetz bezeichnet, weil es auf der Annahme basiert, dass Gase ideales Verhalten zeigen, was bedeutet, dass ihre einzelnen Gasmoleküle keine Wechselwirkungen miteinander haben und ihr Volumen vernachlässigbar ist. Dies ist jedoch in der Realität nicht immer der Fall, daher wird das ideale Gasgesetz eher als ein Modell betrachtet.
Das ideale Gasgesetz ist am meisten gültig unter Bedingungen von niedrigem Druck und hoher Temperatur. Unter diesen Bedingungen nähern sich reale Gase dem idealen Verhalten.