Wie im einführenden Kapitel erwähnt, hängt bei jeder chemischen Reaktionen hängt die Reaktionsgeschwindigkeit der Reaktion von der Konzentration eines oder mehrerer Ausgangsstoffe ab [v = f (A,B, …)]. Häufig liegt daher eine Proportionalität der Geschwindigkeit zu der jeweiligen Konzentration an Ausgangsstoffen vor. Diese Proportionalität wird mit Hilfe einer Proportionalitätskonstanten (der Geschwindigkeitskonstanten) wiedergegeben. Die Formel für die Geschwindigkeit lautet: v= k·Ax·By
Die Potenz, mit der die Konzentration bei der Reaktionsgeschwindigkeit eingeht, ist die sog. Reaktionsordnung, z:B. v = k·A2 ergibt eine Reaktion zweiter Ordnung für die Kompente A (k ist dabei eine Konstante, die aus der graphischen Auftragung der Zeit gegen die Konzentration bestimmt werden kann). Die Reaktionsordnung kann nur experimentell bestimmt werden und nicht aus einer Reaktionsgleichung hergeleitet werden.
Aus dem oben erläuterten Teil ergibt sich, dass die Reaktionsgeschwindigkeit einer Reaktion 2. Ordnung bestimmt ist zu: v = k·A2 bzw v = k·A·B. Die Reaktionsgeschwindigkeit ist von der Konzentration der beiden reagierenden Ausgangsstoffe abhängig.
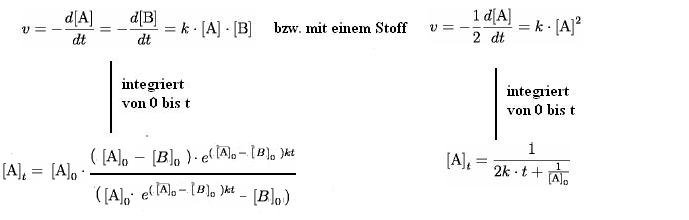
Reaktionsgeschwindigkeits Gleichung
[A]0= Anfangskonzentration von A zum Zeitpunkt t = 0
[B]0= Anfangskonzentration von B zum Zeitpunkt t = 0
[A]t= Konzentration von A zum Zeitpunkt t
Liegt einer der Ausgangsstoffe A oder B (Reaktion A + B -> C) in einem sehr hohen Überschuss vor, so ist die Konzentrationsänderung dieses Stoffes während der Reaktion verschwindend gering ist.
Beispiel: Wasser dient sowohl als Reaktionspartner als auch Lösungsmittel während der Reaktion.
In solchen Fällen entspricht die Reaktionsgeschwindigkeit der einer Reaktion erster Ordnung. Da es sich aber dennoch um eine Reaktion zweier Ausgangsstoffe handelt, spricht man von Reaktionen pseudoerster Ordnung
Chemische Reaktionen verlaufen nicht immer in nur einem Reaktionsschritt, meist entstehen die Produkte aus einer Kette mehrerer Teilreaktionen bzw. Reaktionsschritten. Bei einer Reaktion mehrerer aufeinanderfolgenden Reaktionsschritten bestimmt der langsamste Reaktionsschritt die Geschwindigkeit der Gesamtreaktion.
Die Reaktionsordnung zweiter Ordnung bezieht sich auf eine chemische Reaktion, bei der die Reaktionsgeschwindigkeit proportional zum Quadrat der Konzentration eines reagierenden Stoffes ist.
Die Geschwindigkeitsgleichung für eine Reaktion zweiter Ordnung hätte die Form: r = k[A]2, wobei r die Reaktionsgeschwindigkeit, k die Geschwindigkeitskonstante und [A] die Konzentration des Reaktanten A ist.
Reaktionen, bei denen zwei Moleküle miteinander kollidieren, folgen typischerweise der Reaktionsordnung zweiter Ordnung.
Wenn die Konzentration der Reaktanten verdoppelt wird, würde die Reaktionsgeschwindigkeit einer Reaktion zweiter Ordnung sich um das Vierfache erhöhen.
Ein Beispiel für eine Reaktion zweiter Ordnung könnte die Reaktion von NO (Stickstoffmonoxid) mit Cl2 (Chlorgas) sein, wobei zwei Moleküle NO mit einem Molekül Cl2 reagieren, um zwei Moleküle NOCl zu bilden.
Bei einer Reaktion zweiter Ordnung nimmt die Konzentration der Reaktanten mit der Zeit exponentiell ab.
Die Erhöhung der Temperatur führt zu einer Erhöhung der Reaktionsgeschwindigkeit einer Reaktion zweiter Ordnung, da die Temperatur die Kinetische Energie der Moleküle erhöht und somit die Wahrscheinlichkeit einer Reaktion erhöht.
Anhand der Halbwertszeit lässt sich feststellen, ob eine Reaktion von erster oder zweiter Ordnung ist. Bei einer Reaktion erster Ordnung bleibt die Halbwertszeit konstant, während sie bei einer Reaktion zweiter Ordnung mit sinkender Konzentration zunimmt.
Die Einheit der Geschwindigkeitskonstante k für eine Reaktion zweiter Ordnung in einem Reaktionssystem mit einer einzigen reagierenden Spezies ist L/(mol·s).
Ja, Reaktionen zweiter Ordnung können auch bei mehr als einem reagierenden Stoff auftreten. Die Geschwindigkeitsgleichung würde in diesem Fall die Form r = k[A][B] annehmen, wobei [A] und [B] die Konzentrationen der beiden reagierenden Stoffe sind.