In einem Kapitel in der Anorganischen Chemie werden die Oxidationszahlen als keine (echten) physikalische oder chemische Größen, sondern reine formale Hilfsgrößen. Unter der Oxidationszahl einer Atomsorte (in einer Verbindung) versteht die Ladung, die die Atomsorte haben würde, wenn alle Bindungselektronen dem jeweils stärker elektronegativen Bindungspartner zugeordnet werden (Hinweis: Die Begriffe Oxidationszahl, Oxidationsstufe, Oxidationswert oder auch elektrochemische Wertigkeit haben alle die gleiche Bedeutung). Die Oxidationszahl wird benötigt, um eine Reaktion bzw. den einzelnen Reaktionsteilnehmern die Begriffe Oxidation und Reduktion zuzuweisen. Erhöht sich die Oxidationszahl eines Atoms, so hat diese Elektronen abgegeben und wurde so oxidiert. Erniedrigt sich die Oxidationszahl eines Atoms, so hat dieses Elektronen aufgenommen und wurde so reduziert.
Damit keine Verwechslung mit Ladungen von Ionen auftreten, wird die Oxidationszahl mit positivem bzw. negativen Vorzeichen über das Elementsymbol geschrieben und zwar mit römischen Ziffern. Im folgenden Kapitel wird die Bestimmung von Oxidationszahlen an einigen Beispielen erläutert.
Als kurze Wiederholung die Regeln zur Bestimmung der Oxidationszahl:
Die beiden wichtigsten Regeln lauten, dass Atome im elementaren Zustand immer die Oxidationszahl Null aufweisen. Bei einatomigen Ionen entspricht die Oxidationszahl der Ionenladung des Ions.
Daneben gibt es noch weitere Regeln zur Bestimmung der Oxidationszahl:
Wasserstoffchlorid (HCl)

Oxidationszahl von HCl
Wasserstoffchlorid ist eine binäre Verbindung aus einem H-Atom und einem Cl-Atom, wobei das Cl-Atom der elektronegativere Bindungspartner ist. Daher werden bei der Bestimmung der Oxidationszahlen beide Bindungselektronen dem Cl-Atom zugerechnet. Damit hat das H-Atom nach der Bindungsspaltung formal 0 Valenzelektronen und das Cl-Atom formal 8 Valenzelektronen. Wasserstoff befindet sich im Periodensystem in der ersten Hauptgruppe, hat daher als Element 1 Valenzelektron. Chlor hat als Mitglied der 7. Hauptgruppe als Element 7 Valenzelektronen. Nun können wir die jeweilige Differenz = Oxidationszahl berechnen (Oxidationszahl = Zahl der VE – Zahl der formalen VE nach Bindungstrennung
Kohlenstoffdioxid
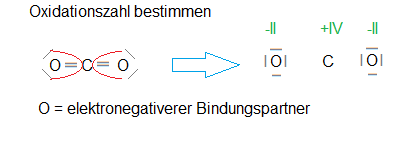
Oxidationszahl Kohlenstoffdioxid
Kohlenstoffdioxid ist eine Verbindung aus einem C-Atom und zwei O-Atomen, wobei das O-Atom der elektronegativere Bindungspartner ist. Daher werden bei der Bestimmung der Oxidationszahlen die Bindungselektronen der Doppelbindungen (C=O) dem O-Atom zugerechnet. Damit hat das C-Atom nach der Bindungsspaltung formal 0 Valenzelektronen und das O-Atom formal 8 Valenzelektronen. Sauerstoff befindet sich im Periodensystem in der sechsten Hauptgruppe, hat daher als Element 6 Valenzelektronen. Kohlenstoff hat als Mitglied der 4. Hauptgruppe als Element 4 Valenzelektronen. Nun können wir die jeweilige Differenz = Oxidationszahl berechnen (Oxidationszahl = Zahl der VE – Zahl der formalen VE nach Bindungstrennung
Weitere Übungsbeispiele mit Lösungen finden sich im Kapitel Übungs- und Trainingsaufgaben.Aus diesem Beispielen lassen sich auch Trends ableiten, die bei der Bestimmung von Oxidationszahlen hilfreich sind:
Die Oxidationszahlen sind hypothetische Ladungen, die ein Atom in einer chemischen Verbindung hätte, wenn alle Bindungen perfekt ionisch wären. Sie helfen dabei, Redoxreaktionen zu analysieren.
Die Oxidationszahl eines Atoms in einer Verbindung wird bestimmt, indem man die Zahl der Elektronen, die es gewinnt oder verliert, um eine volle Außenschale zu bekommen, betrachtet.
Die Oxidationszahl von Sauerstoff in den meisten Verbindungen ist -2.
Die Oxidationszahl von Wasserstoff in den meisten Verbindungen ist +1.
Die Oxidationszahl von Natrium in Natriumchlorid ist +1.
Die Summe der Oxidationszahlen in einer neutralen Verbindung ist immer null.
Die Oxidationszahl von Stickstoff in NH3 ist -3.
Die Oxidationszahl von Chlor in Cl2 ist null.
Ja, die Oxidationszahl eines Elements kann in verschiedenen Verbindungen unterschiedlich sein. Zum Beispiel hat Sauerstoff in Peroxiden eine Oxidationszahl von -1 statt der üblichen -2.
Eine Redoxreaktion ist eine chemische Reaktion, bei der die Oxidationszahlen der Atome verändert werden. Es beinhaltet den Transfer von Elektronen zwischen Reaktionsteilnehmern.