Oft stellt sich die Frage, wie stabil Verbindungen sind. Die Atome in Verbindungen werden durch die chemische Bindung zusammengehalten. Alle chemischen Bindungen beruhen auf der Bildung des energetisch günstigsten Zustands (energieärmster Zustand). Häufig wird hierbei vor allem die Bildung einer voll besetzte Außenschale (Edelgaskonfiguration) genannt. Im Folgenden soll näher auf die Stabilität von Verbindungen eingegangen.
Die Stabilität von chemischen Verbindungen
Chemische Verbindungen bestehen i. d. R. aus mehreren Atomen bzw. Ionen, diese werden durch die chemische Bindung (Atombindung, Metallbindung und Ionenbindung) zusammengehalten. Grundlage dieser chemischen Bindung sind elektrostatische Wechselwirkungen (Metall- und Ionenbindung) oder Wechselwirkungen von Valenzelektronen zweier Atome, die ein gemeinsames Elektronenpaar bilden (Atombindung).
Nun stellt sich die Frage, wie man herausfinden kann, wie stabil eine Verbindung ist
Dabei stellt sich die Frage, was denn eine stabile Verbindung ist. Dies könnte man so beantworten, dass man die Verbindung in einer Reaktion als Produkt erhalten und diese auch isolieren kann. Betrachtet man eine (exotherme) Reaktion, so gibt es zwei “Arten” von stabilen Produkten.
- Das eine ist das kinetisch stabile Produkt, dass als Erstes bei einer Reaktion entsteht und an sich ein isolierbares (nachweisbares) Produkt bildet. Dieser kinetisch stabile Zustand ist aber meist nur ein metastabiler Zustand, d.h. wird genügend Aktivierungsenergie hinzugefügt, kann System den energetisch günstigsten Zustand erreichen (thermodnamisch stabile Zustand). In der Regel ist die Aktivierungsenergie so gering, dass praktisch nur der thermodynamisch stabile Zustand einer Verbindung existiert.
- Das anders ist das thermodynamisch stabile Produkt. Ein Produkt ist im thermodynamischen Sinne stabil, wenn die betrachtete Reaktion (= Herstellung des Produktes) eine negative Änderung der Gibbs- Energie aufweist (D G < 0). Man könnte es auch so formulieren, dass die Änderung der Gibbs-Energie bei jeder chemischen Änderung an der thermodynamisch stabilen Verbindung positiv ist (D G > 0)
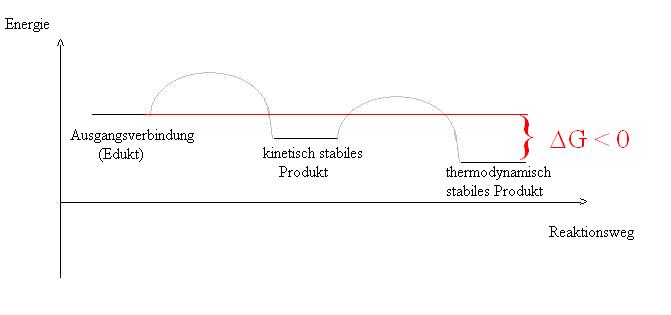
Somit wäre geklärt, wie stabil Verbindungen in Bezug auf die in der Verbindung enthaltenen Elemente sind (-> Verbindung zerfällt in die Elemente, z.B. CS2 -> C + 2S). Ist der Änderung der Gibbs-Energie der Reaktion von den Elementen zur Verbindung negativ (D G < 0), so handelt es sich um eine stabile Verbindung (gegenüber der in der Verbindung enthaltenen Elemente). Nicht vergessen werden sollte, dass dies für das Reaktionsprodukt nur gilt, wenn dem Produkt keine Energie zugeführt wird. So lässt sich beispielsweise die thermodynamisch stabile Verbindung Wasser mit Hilfe der Elektrolyse (Zuführung elektrischer Energie) in ihre Bestandteile -Wasserstoff und Sauerstoff – zerlegen.
Zusätzlich kann man sich noch fragen, wie stabil eine Verbindung gegenüber einer anderen Verbindung ist:
Der Vergleich zwischen Elementen ist wesentlich einfacher (dies wird hier auch auf Lernort-Mint.de besprochen), dabei macht man sich die Elektrochemische Spannungsreihe zu nutzen. So reagiert die reduzierte Form eines Elementes mit der oxidierten Form eines Elements, wenn die reduzierte Form das negativere Normalpotential aufweist, z.B. Na (red. Form, – 2,71 V) + Cl 2 (ox. Form, + 1,36 V) zu NaCl (genaueres siehe unter: Redoxvorgang Vorhersage).
Die Frage nach der Stabilität einer Verbindung gegenüber anderen Elementen oder Verbindungen ist nicht so leicht allgemeingültig zu beantworten. Da bei der Frage nach der “Stabilität” immer auch zu fragen ist, Stabilität in Bezug auf was, z.B. gegenüber Säuren, gegenüber Oxidationsmittel, Reduktionsmittel u.s.w. So gibt es auch für die unterschiedlichen Konzepte unterschiedliche Methoden:
- Base + Säure in einer Säure-Base-Reaktion – Hilfsmittel sind die Säurekonstanten pKs bzw. das HASB-Prinzip
- Verbindungen gg. Oxidationsmittel bzw. Reduktionsmittel – Hilfsmittel sind die Normalpotentiale bzw. deren Differenz D E°
Da es so viele unterschiedliche Konzepte gibt, lässt sich die Frage nach der Stabilität einer Verbindung gegenüber anderen nicht allgemeingültig klären (man kann thermodynamisch argumentieren, dass sich in einem System (z.B. zwei Verbindungen) immer die energetisch günstigsten Produkte bilden, energetisch günstige Produkte sind z.B. Wasser). Diese Systeme zu berechnen würde aber tief in die physikalische Chemie bzw. Quantentheorie führen, so dass es besser ist, allgemeine Reaktionsschemata zu kennen (nachfolgend sind ein paar Beispiele aufgelistet):
- Metalloxide lösen sich in der Regel in Wasser unter Bildung der entsprechenden Base (Metallhydroxid)
- Nichtmetalloxide lösen sich in der Regel in Wasser unter Bildung der entsprechenden Säure.
- Unedle Metalle und Wasser reagieren zu Wasserstoff und der entsprechenden Base (Metallhydroxid).
- Edelmetalle reagieren nicht mit nichtoxidierenden Brönsted-Säuren (eine oxidierende Säure ist z.B. HNO3 )
weiterführende Informationen auf Lernort-Mint.de
Stabilität von chemischen Verbindungen – Testfragen/-aufgaben
1. Was bedeutet die Stabilität von chemischen Verbindungen?
Die Stabilität von chemischen Verbindungen bezieht sich auf die Fähigkeit dieser Substanzen, ihre strukturelle Integrität unter bestimmten Bedingungen wie Temperatur, Druck oder Anwesenheit von anderen Substanzen beizubehalten.
2. Was sind stabile und instabile chemische Verbindungen?
Stabile chemische Verbindungen sind solche, die nicht leicht zerfallen oder in andere Verbindungen umgewandelt werden. Instabile Verbindungen sind anfällig für Veränderungen und können oft spontan oder unter geringem Einfluss in andere Verbindungen umgewandelt werden.
3. Was beeinflusst die Stabilität einer chemischen Verbindung?
Die Stabilität einer chemischen Verbindung wird von mehreren Faktoren beeinflusst, darunter die Art der chemischen Bindung, die Struktur des Moleküls, die umgebenden Bedingungen wie Temperatur und Druck sowie die Anwesenheit anderer Substanzen.
4. Was ist das Oktettregel und wie beeinflusst es die Stabilität einer Verbindung?
Die Oktettregel besagt, dass Atome dazu tendieren, Moleküle mit acht Elektronen in ihrer äußeren Schale zu bilden, da dies stabile Konfigurationen sind. Dies beeinflusst die Stabilität von Verbindungen, da Atome, die diese Stable Oktettstruktur erreichen können, dazu neigen, stabilere Verbindungen zu bilden.
5. Was bedeutet thermodynamische Stabilität in Bezug auf chemische Verbindungen?
Thermodynamische Stabilität bezieht sich auf die Fähigkeit einer Verbindung, Energie in Form von Wärme über einen längeren Zeitraum zu behalten. Eine thermodynamisch stabile Verbindung wird ihre Energie nicht ohne den Einfluss eines äußeren Faktors abgeben.
6. Wie beeinflussen Katalysatoren die Stabilität von chemischen Verbindungen?
Katalysatoren können die Stabilität von chemischen Verbindungen beeinflussen, indem sie die Aktivierungsenergie einer chemischen Reaktion senken. Dies kann dazu führen, dass ansonsten stabile Verbindungen reagieren und zu anderen Produkten zerfallen.
7. Wie verändert die Temperatur die Stabilität von chemischen Verbindungen?
Die Temperatur kann die Stabilität von chemischen Verbindungen erheblich beeinflussen. Bei hohen Temperaturen können Verbindungen, die bei Raumtemperatur stabil sind, beginnen, zu zerfallen oder zu reagieren.
8. Wie wird die Stabilität einer chemischen Verbindung gemessen?
Die Stabilität einer chemischen Verbindung wird oft durch ihre Zersetzungstemperatur, ihre Reaktionsneigung mit anderen Stoffen oder ihre Fähigkeit, Energie in Form von Wärme zu speichern, gemessen.
9. Was ist die Rolle der Elektronenaffinität bei der Stabilität von chemischen Verbindungen?
Die Elektronenaffinität misst die Energieänderung, die auftritt, wenn ein Elektron zu einem isolierten Atom hinzugefügt wird. Atome mit höherer Elektronenaffinität neigen dazu, stabilere Verbindungen zu bilden, da sie bereit sind, Elektronen aufzunehmen.
10. Was ist die Rolle der Ionisierungsenergie bei der Stabilität von chemischen Verbindungen?
Die Ionisierungsenergie ist die Energie, die benötigt wird, um ein Elektron von einem Atom zu trennen. Atome mit hoher Ionisierungsenergie neigen dazu, stabilere Verbindungen zu bilden, da sie ihre Elektronen nicht leicht abgeben.
