Die Ionenbindung basiert auf der elektrostatischen Anziehung zwischen positiv und negativ geladener Ionen, meist also aus Metall- und Nichtmetallatomen, wobei die Kationen durch Elektronenabgabe aus Metallatomen und Anionen durch Elektronenaufnahme des Nichtmetallatoms entstehen.
Zwischen entgegengesetzt geladenen Ionen – Anion und Kation – herrschen elektrostatische Anziehungskräfte, die sog. Coulombschen Kräfte. Diese Anziehungskräfte wirken nach allen Seiten gleichmäßig und halten die Kationen und Anionen zusammen. Daraus ergibt sich eine typische räumliche Anordnung der entgegengesetzt geladenen Ionen im Kristallgitter und führt zu großen Ionenverbänden und nicht zu einem Ionenpaar.
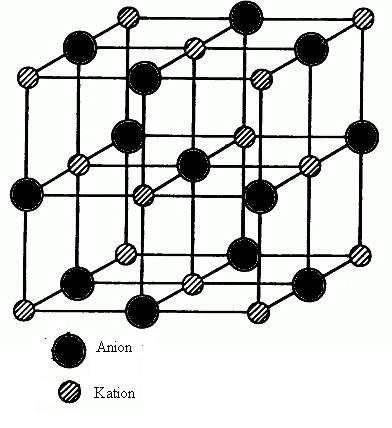
Bindung der Ionen
Eine Ionenbindung ist eine chemische Bindung, die durch die Anziehung von positiv geladenen Ionen (Kationen) und negativ geladenen Ionen (Anionen) entsteht. Diese entsteht, wenn ein Atom Elektronen an ein anderes Atom abgibt oder aufnimmt, um eine stabile Elektronenkonfiguration zu erreichen.
Ein Beispiel für eine chemische Verbindung mit Ionenbindung ist NaCl (Kochsalz). Hier gibt das Natriumatom ein Elektron ab und das Chloratom nimmt das Elektron auf, wodurch beide Ionen entstehen.
Während eine Ionenbindung durch die Anziehung von positiv und negativ geladenen Ionen entsteht, entsteht eine kovalente Bindung, wenn zwei Atome Elektronen teilen, um eine stabile Elektronenkonfiguration zu erreichen.
Eine Ionenbindung entsteht, wenn ein Atom Elektronen an ein anderes Atom abgibt oder aufnimmt. Dies führt zur Bildung von positiv und negativ geladenen Ionen, die sich gegenseitig anziehen und eine Ionenbindung bilden.
Ja, Ionenverbindungen sind in der Regel in Wasser löslich. Das liegt daran, dass die Wassermoleküle die Ionen der Verbindung umgeben und sie so voneinander trennen können, was zum Auflösen der Verbindung führt.
Eine Substanz mit Ionenbindung hat normalerweise einen hohen Schmelz- und Siedepunkt, ist in Wasser löslich und leitet Elektrizität, wenn sie geschmolzen oder in Wasser gelöst ist.
Ionenverbindungen leiten Elektrizität, wenn sie in Wasser gelöst oder geschmolzen sind, da die Ionen frei beweglich sind und einen elektrischen Strom übertragen können.
Substanzen mit Ionenbindung haben eine kristalline Struktur, in der die Ionen in einem geordneten, wiederholten Muster angeordnet sind.
Ionenverbindungen haben hohe Schmelz- und Siedepunkte, weil die Ionen stark aneinander gebunden sind. Es braucht eine erhebliche Menge an Energie, um diese starken Bindungen zu brechen und die Substanz zu schmelzen oder zu verdampfen.
Die Elektronegativität spielt eine entscheidende Rolle bei der Bildung von Ionenbindungen. Wenn ein Atom eine höhere Elektronegativität hat als das andere, neigt es dazu, Elektronen anzuziehen und aufzunehmen. Dadurch entsteht eine Ionenbindung.