Im Rahmen der Allgemeinen Chemie lernt man die drei grundsätzlichen Stoffklassen “molekulare Stoffe”, “Salze” und “Metalle”, sowie deren Bindungstypen “Atombindung”, “Ionenbindung” und “Metallbindung” kennen. Alle Bindungen beruhen dabei auf dem gleichen “physikalischen” Prinzip, der anziehenden Wechselwirkung zwischen geladenen Teilchen vor. Diese geladenen Teilchen können Protonen (Kernladung), Elektronen oder Ionen sein
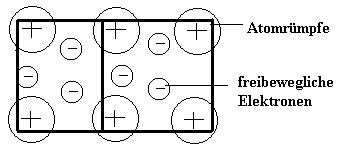
Eine metallische Bindung liegt bei Metallen und in Legierungen vor, das heißt es sind immer nur Metallatome an der Bindung beteiligt. Daher lässt sich die Metallbindung von der Atombindung bzw. Ionenbindung unterscheiden. Ebenfalls wie die anderen Bindungstypen versucht die anziehende Wechselwirkung zwischen zwei entgegengesetzt geladenen Teilchen die Metallbindung. Die Metallbindung ist dabei frei beweglichen (negativ geladenen) Elektronen und positiv geladenen Metallatomrümpfen gekennzeichnet.
Die Bildung der positiv geladenen Metallatomrümpfe lässt sich mit Hilfe des Bohrschen Atommodells und der Edelgaskonfiguration erklären. Die meisten Hauptgruppenmetalle (I bis III. Hauptgruppe) haben 1 bis 3 Valenzelektronen auf der äußersten Schale. Damit die Metallatome eine Edelgaskonfiguration (volle Valenzschale mit 8 Valenzelektronen) erreichen, geben die Metalle die 1 bis 3 Valenzelektronen ab (dies ist energetisch günstiger, als 7 bis 5 Valenzelektronen aufzunehmen) und erreichen eine Edelgaskonfiguration.
Die Valenzelektronen von Metallatomen sind nur schwach gebunden und können daher leicht abgetrennt werden. So bilden sich positiv geladene Metallionen (=> Elektronenmangel), die sogenannte Atomrümpfe, die das Metallgitter bilden. Da in einem Metall (die bevorzugt Valenzelektronen abgeben) keine anderen “Bindungspartner” vorhanden sind, die die abgegebenen Elektronen aufnehmen. Daher sind die abgegebenen Valenzelektronen nun nicht mehr an einem einzelnen Metallatom gebunden und bewegen sich innerhalb des Gitters nahezu frei.
Metallbindung
Die frei beweglichen Elektronen bewegen sich um alle Metallatome und halten diese so zusammen, wobei sich das sogenannte Metallgitter bildet. Daher sind die Metallatomrümpfe auf festen Plätzen im Metall(gitter) fixiert, daher ist ein Metall auch (im Vergleich zu Salzen) ein Stoff mit einem hohen Härtegrad.
Unter einer Metallbindung versteht man die chemische Bindung zwischen positiven Metall-Ionen und einem Elektronengas. Sie kommt hauptsächlich bei Metallen und Legierungen vor.
Bei der Bildung einer Metallbindung sind elektrostatische Kräfte beteiligt, welche zwischen positiv geladenen Metall-Ionen und den negativ geladenen Elektronen auftreten.
Metalle sind gute Stromleiter, da die Elektronen im Metallbindungsgitter frei beweglich sind und daher beim Anlegen einer elektrischen Spannung einen Stromfluss ermöglichen.
Ein Elektronengas ist eine Bezeichnung für die freien Elektronen in einer Metallbindung, die sich über das gesamte Kristallgitter des Metalls bewegen können.
Bei der Bildung einer Legierung werden verschiedene Metalle miteinander vermischt. Die Metallbindung bleibt bestehen, aber das Kristallgitter verändert sich und damit auch die Eigenschaften des resultierenden Materials.
Metalle sind formbar und dehnbar, weil die Metallbindungen in alle Raumrichtungen gleichermaßen stark sind. Dadurch können sich die Metallionen relativ zueinander verschieben, ohne dass die Bindung bricht.
Metalle sind gute Wärmeleiter, da die freien Elektronen in der Metallbindung gut Wärmeenergie aufnehmen und im gesamten Kristallgitter verteilen können.
Ja, bei sehr hohen Temperaturen kann die Metallbindung brechen, da die benötigte Energie für das Lösen der Bindungen erreicht wird und die Metalle in einen gasförmigen Zustand übergehen.
Elemente aus der s- und d-Gruppe des Periodensystems gehen hauptsächlich Metallbindungen ein.
Bei einer kovalenten Bindung teilen sich zwei Atome mindestens ein Elektronenpaar. Bei der Metallbindung befinden sich die Elektronen in einem Elektronengas und sind nicht fest an ein bestimmtes Atom gebunden.