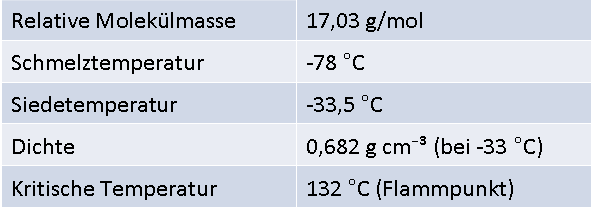
Der Stoff Ammoniak (Formel: NH3) ist bei Raumtemperatur ein farbloses, stechend riechendes, giftiges Gas. Wie aus der Formel ersichtlich, setzt sich Ammoniak aus einem Teil Stickstoff (N) und drei Teilen Wasserstoff (H) zusammen. Auf natürlichem Weg entsteht Ammoniak bei der Eiweißzersetzung und kommt in vulkanischen Ausbrüchen vor.
Ammoniak ist ein bedeutender Ausgangsstoff für viele wichtige, alltägliche Produkte. So ist beispielsweise Ammoniak die Basis für Amine und Harnstoffe und ist daher Basis für Farbstoffe bzw. Kunststoffe und Düngemittel. Die Bedeutung von Ammoniak zeigt sich dadurch, dass etwa 80 % des industriell hergestellten Ammoniaks für die Herstellung von verschiedenen Düngemittel genutzt wird.
Ammoniak kann aus den Elementen Wasserstoff und Stickstoff hergestellt werden, dabei liegt eine Gleichgewichtsreaktion zwischen den Elementen Wasserstoff bzw. Stickstoff und dem Reaktionsprodukt Ammoniak vor. Die Reaktion N2 + 3H2 => 2NH3 ist exotherm, daher kann nach dem Prinzip von Le Chatelier die Ausbeute an Ammoniak gesteuert werden (da es sich um eine Gleichgewichtsreaktion handelt). Gemäß dem Prinzip von Le Chatelier müsste die Ausbeute an Ammoniak maximal sein, wenn die Temperatur gering und der Druck hoch ist. Da moderne Verfahren mit einer Temperatur von ca. 450°C und einem Druck von ca. 230 bis 330 bar arbeiten, zeigt sich, dass “theoretische” Ansätze wie das Prinzip von Le Chatelier nicht immer vollständig anwendbar ist.
Exkurs: Prinzip von Le Chatelier
Nach dem Prinzip von Le Chatelier kann jede Gleichgewichtsreaktion durch die Steuerung der Reaktionstemperatur beeinflusst werden:
Ähnliches gilt für den Druck als Reaktionsbedingung, auch hierdurch lässt sich das Gleichgewicht einer Reaktion beeinflussen.
Die Gleichgewichtsreaktion zwischen den Elementen und dem Ammoniak ist eine exotherme Reaktion, daher liegt das Gleichgewicht bei niedrigen Temperaturen auf der Seite des Ammoniaks und bei hohen Temperaturen auf der Seite von Stickstoff und Wasserstoff. Dies bedeutet, eine niedrige Temperatur begünstigt die Bildung von Ammoniak, eine hohe Temperatur den Zerfall des Ammoniaks.
Da bei der Ammoniaksynthese aus 1 mol Stickstoff und 3 mol Wasserstoff insgesamt 2 mol Ammoniak gebildet werden, begünstigt ein hoher Druck die Bildung des Ammoniaks, während niedrige Drücke den Zerfall von Ammoniak begünstigen.
Würde man nun die Reaktion von Stickstoff und Wasserstoff zu Ammoniak unter diesen Bedingungen durchführen (niedrige Temperatur und hoher Druck), so wäre die Reaktionsgeschwindigkeit äußerst gering. Dies liegt vor allem an dem Reaktionsträgen Stickstoff.
Aus diesem Grund forschten viele Unternehmen nach wirtschaftlich sinnvollen Reaktionsbedingungen, um eine hohe Ausbeute an Ammoniak zu erreichen. So auch Fritz Haber und Carl Bosch, die gemeinsam das Haber-Bosch-Verfahren entwickelten. Das Haber-Bosch-Verfahren ist seitdem das wichtigste großtechnisches Verfahren zur Herstellung von Ammoniak aus Wasserstoff und Stickstoff.
Beim Haber-Bosch-Verfahren wird ein Druck von 250 bar bis 350 bar als eine Reaktionsbedingung gewählt (würde man einen höheren Druck wählen, benötigt man spezielle Vorrichtungen, was erhebliche Kosten verursachen würden). Folgende Reaktionsbedingungen liegen beim Haber-Bosch-Verfahren vor:
Ammoniak ist ein farbloses Gas mit einer starken charakteristischen Geruch. Es wird hauptsächlich zur Herstellung von Düngemitteln, aber auch für Reinigungsmittel und in der Kälteindustrie verwendet.
Ammoniak ist ein Molekül, das aus einem Atom Stickstoff (N) und drei Atomen Wasserstoff (H) besteht. Seine chemische Formel ist NH3.
Für die industrielle Herstellung von Ammoniak werden Stickstoff und Wasserstoff bei hohen Temperaturen und Drücken in Gegenwart eines Katalysators umgesetzt.
Das Haber-Bosch-Verfahren wurde von den deutschen Chemikern Fritz Haber und Carl Bosch entwickelt und um 1910 erstmals eingesetzt.
Im Haber-Bosch-Verfahren wird Stickstoffgas und Wasserstoff unter hohen Temperaturen (~500°C) und Drücken (~200atm) in Gegenwart eines Eisenkatalysators umgesetzt, um Ammoniak zu erzeugen.
Das Haber-Bosch-Verfahren hat eine effiziente Ausbeute von etwa 10-20% in einem einzigen Durchgang, wobei das ungesetzte Gas für weitere Zyklen recycelt wird.
Das Haber-Bosch-Verfahren ermöglicht die Herstellung von künstlichen Düngemitteln, die Stickstoff enthalten, eines wichtigen Nährstoffs für Pflanzen.
Die Ammoniakherstellung hat gravierende Auswirkungen auf die Umwelt. Es verbraucht eine große Menge an Energie, erzeugt Treibhausgase und es besteht ein Risiko der Emission von Ammoniak in die Atmosphäre, das zu Luftverschmutzung führt.
Ammoniak ist ein wichtiger Bestandteil des Stickstoffkreislaufs in der Atmosphäre. Es kann jedoch zu Problemen führen, wenn es sich in zu großen Mengen ansammelt und zu Saurem Regen beiträgt.
Es gibt laufende Forschungen, um alternative Methoden zur Ammoniakherstellung zu finden, die weniger energieintensiv und umweltschädlich sind. Beispielsweise wird die Elektrolyse von Wasser unter Verwendung erneuerbarer Energiequellen erforscht.