Alkane sind chemische Verbindungen, die dem Fachgebiet der organischen Chemie zugeordnet werden. Dabei bilden die Alkane die Stoffklasse der gesättigten, kettenförmigen Kohlenwasserstoffe, d.h die Verbindungen bestehen nur aus Kohlenstoff- und Wasserstoffatomen (kettenförmig) und ohne Mehrfachbindung in ihrer Struktur (gesättigt). Die allgem. Summenformel für Alkane ist CnH2n+2.
Cycloalkane sind ebenfalls gesättigte Kohlenwasserstoffe, im Gegensatz zu den Alkanen sind die Atome in der Verbindung aber nicht kettenförmig, sondern ringförmig angeordnet. Die allgem. Summenformel für Cycloalkane ist CnH2n.
Alkane lassen sich aus einigen organischen Verbindungen herstellen, im nachfolgenden Schema sind einige dieser Möglichkeiten aufgezeigt:
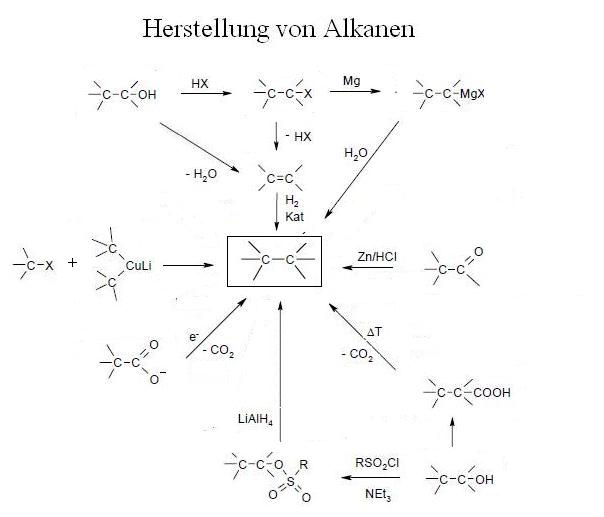
Alkane können aus unverzweigten (linearen) wie aus verzweigten Kohlenstoffketten aufgebaut sein. Die unverzweigten Verbindungen werden als normale Kohlenwasserstoffe oder n-Alkane bezeichnet, die verzweigten Alkane werden mit dem Begriff iso-Alkan gekennzeichnet. So ist es möglich, dass Moleküle eine gleiche Summenformel aufweisen, aber verschiedene Strukturformeln besitzen (dieses Phänomen nennt man Isomerie).
Bei Alkanen ist eine unterschiedliche Anordnung der Kohlenstoffatome (kettenförmig/verzweigt) bei gleicher Summenformel möglich, das als Konstitutionsisomerie bezeichnet wird. Die Benennung der unterschiedlichen Isomere erfolgt nach den IUPAC-Regeln für organische Verbindungen.
Daneben ist eine Rotation der CHx-Gruppen um die C-C-Bindung möglich, dadurch ergeben sich verschiedene räumliche Anordnungen, die sich nur im Energieinhalt der Verbindung unterscheiden, dass als Konformationsisomerie (z.B. ekliptisch) bezeichnet wird. Die Umwandlung der einzelnen Konformationen erfolgt bei Raumtemperatur so rasch, dass sie sich nicht trennen lassen.
Antwort: Alkane sind gesättigte Kohlenwasserstoffe, das bedeutet, dass sie ausschließlich aus Wasserstoff (H) und Kohlenstoff (C) in der Struktur mit sogenannten einzelnen Bindungen bestehen.
Antwort: Das einfachste Alkan ist Methan. Seine chemische Formel lautet CH4.
Antwort: Die allgemeine Summenformel der Alkane lautet CnH2n+2.
Antwort: Die ersten vier Alkane nach Methan sind: Ethan (C2H6), Propan (C3H8), Butan (C4H10) und Pentan (C5H12).
Antwort: Alkane sind unpolar, das bedeutet, sie sind weder wasserlöslich noch gute Stromleiter. Sie weisen zudem eine geringe Reaktivität auf.
Antwort: Der Siedepunkt von Alkanen steigt mit zunehmender Molekülgröße.
Antwort: Eine homologe Reihe beschreibt eine Reihe von Stoffen, die sich in ihrer chemischen Struktur und ihren physikalischen Eigenschaften systematisch unterscheiden. Bei den Alkanen bedeutet das, dass jedes nachfolgende Molekül ein zusätzliches CH2 enthält.
Antwort: Bei der vollständigen Verbrennung von Alkanen entstehen Wasser und Kohlenstoffdioxid.
Antwort: Ein verzweigtes Alkan ist ein Alkan, dessen Hauptkette Seitenketten aufweist. Ein bekanntes Beispiel für ein verzweigtes Alkan ist Isobutan.
Antwort: Alkane finden breite Anwendung, zum Beispiel als Treibstoffe (z.B. Methan ist der Hauptbestandteil von Erdgas), oder in der chemischen Industrie als Rohstoff zur Herstellung anderer chemischer Verbindungen.