In der organischen Chemie kommt es oft vor, dass Verbindungen mit gleicher Summenformel unterschiedliche physikalische Eigenschaften (wie z.B. Siedepunkt) aufweisen. Betrachtet man diese Summenformel genauer bzw. dessen Struktur, dann lässt sich eine unterschiedliche Konstitution (Verknüpfung der Atome) oder Konfiguration (räumliche Anordnung).
Im letzten Kapitel wurde die Fischer-Projektion zur Bestimmung der Konfiguration von Molekülen behandelt. Nun folgte eine weitere Nomenklatur, ein Nomenklaturprinzip, welches die eindeutige Wiedergabe der Konfiguration eines asymmetrisch substituierten C-Atoms erlaubt, die sog. Cahn-Ingold-Prelog-Nomenklatur. (Die Nomenklatur nach Fischer ist nicht auf alle Moleküle anwendbar, heute nur noch auf Aminosäuren und Zucker).
| Regel 1 | Das direkt an das Chiralitätszentrum gebundene Atom mit der höchsten Ordnungszahl (siehe PSE) erhält die höchste Priorität. |
| Regel 2 | Sind zwei gleiche Atome (gleiche Ordnungszahl) am direkt an das Chiralitätszentrum gebunden, wird die nächste Bindungsebene betrachtet, die sogenannte 2.Sphäre: Das Atom hat die höhere Priorität, das an ein Atom gebunden ist, mit der höheren Ordnungszahl. Sollte erneut das gleiche Vorliegen, dringt man in die 3.Sphäre vor. |
| Regel 3 | Doppel- und Dreifachbindungen werden so gehandhabt, als ob die jeweilige Gruppe/ Atom in dieser Menge vorhanden wäre.Beispiel: 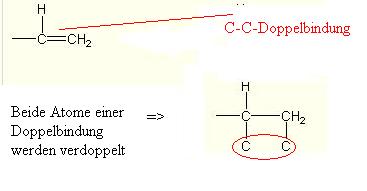 |
Beispiel:
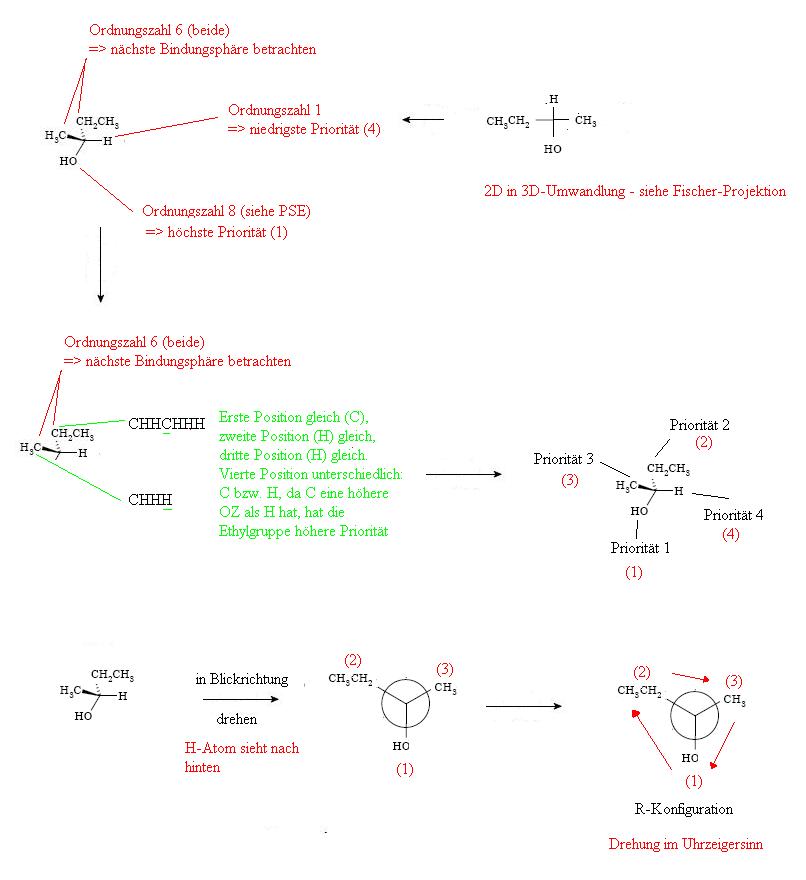
Die Abkürzung CIP steht für Cahn-Ingold-Prelog.
Die CIP-Nomenklatur wird in der Chemie angewendet, um die Stereochemie von Molekülen zu beschreiben und die Konfiguration von Chiralitätszentren zu bestimmen.
Die Prioritätsregeln sind relevant, weil sie die Reihenfolge der Atome oder Gruppen in Chiralitätszentren festlegen. Dies ist entscheidend für die Bestimmung der absoluten Konfiguration.
Ein Molekül muss mindestens ein Chiralitätszentrum aufweisen, um die CIP-Nomenklatur anzuwenden.
Wenn Moleküle das gleiche Molekulargewicht und die gleiche Summenformel haben, sich jedoch in der Anordnung der Atome unterscheiden, werden sie als Isomere bezeichnet.
Der Unterschied zwischen den beiden Konfigurationen (R) und (S) ist die unterschiedliche Drehrichtung der Prioritäten: (R)-Konfiguration besagt, dass sich die Gruppen im Uhrzeigersinn drehen, während (S)-Konfiguration eine Drehrichtung gegen den Uhrzeigersinn aufweist.
Um die Konfiguration an einem Chiralitätszentrum zu ermitteln, ordnet man die Gruppen gemäß den Prioritätsregeln, blickt von der niedrigsten Prioritätsgruppe aus auf das Chiralitätszentrum und bestimmt die Drehrichtung der höherpriorisierten Gruppen.
Bei mehreren Chiralitätszentren wird für jedes Chiralitätszentrum eine (R)- oder (S)-Bezeichnung vergeben, beginnend vom höchstpriorisierten Ende des Moleküls.
Ein Molekül ist chiral, wenn es nicht mit seinem Spiegelbild zur Deckung gebracht werden kann, was oft auf das Vorhandensein von mindestens einem Chiralitätszentrum zurückzuführen ist.
Die Prioritätsregel in der CIP-Nomenklatur basiert im Allgemeinen auf der Atommasse. Dabei wird der höchsten Atommasse die höchste Priorität zugeordnet. Bei mehrfach gebundenen Atomen wird die Bindung aufgelöst und das Atom so oft berücksichtigt, wie es gebunden ist.