Das Massenwirkungsgesetz bzw. seine Anwendung dient beispielsweise dazu, um im fortgeschrittenen Chemieunterricht “Gleichgewichtskonstanten” zu berechnen oder Aussagen über die Stabilität von Reaktionsprodukten aussagen zu können. Im Rahmen der Allgemeinen Chemie lernt man, das Massenwirkungsgesetz für eine beliebige Reaktion aufzustellen. Mit Hilfe dieses Massenwirkungsgesetzes kann im Rahmen der Allgemeinen Chemie ausgesagt werden, in weit eine chemische Reaktion abläuft.
Definition im Rahmen der Allgemeinen Chemie: Das Massenwirkungsgesetz gibt dabei den Zusammenhang zwischen der Konzentration der Produkte und der Ausgangsstoffe einer chemischen Reaktion an.
Die Formel zur Berechnung des Massenwirkungsgesetzes lässt sich wie folgt beschreiben: Das Massenwirkungsgesetz ist das “mathematische Produkt” der Konzentrationen der Produkte dividiert durch das Produkt der Konzentrationen der Ausgangsstoffe. Die Konzentrationen der Produkte erscheinen daher im Zähler, die der Ausgangsstoffe im Nenner. Liegt in der Reaktionsgleichung ein sogenannter stöchiometrischer Faktor vor, so wird dieser stöchiometrische Faktor im Massenwirkungsgesetz als Exponenten über der zugehörigen Konzentration geschrieben.
Allgemeines Beispiel:

allgemeines Beispiel einer Reaktionsgleichung
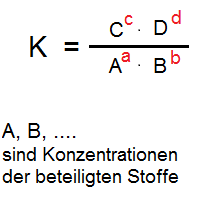
Massenwirkungsgesetz
Dazugehöriges Massenwirkungsgesetz:
So einfach leitet man das Massenwirkungsgesetz her ( die Produkte einer Reaktion stehen im Zähler, die Ausgangsstoffe im Zähler. Aus dem “+” in einer chemischen Reaktion wird ein “·” (Multiplikation) und aus dem “·” in einer chemischen Reaktion wird ein “Exponent”.Erst jetzt folgt hier der Hinweis, dass das Aufstellen des Massenwirkungsgesetzes nur “erlaubt” ist, wenn die chemische Reaktion im Gleichgewicht ist. Das bedeutet, wir dürfen das Massenwirkungsgesetz einer Reaktion nur dann aufstellen, wenn diese nicht vollständig abläuft, d.h. es muss im Reaktionssystem sowohl Ausgangsstoffe und Produkte zu finden sein (zu jedem Zeitpunkt). Warum dies so ist, können wir leicht verstehen, nachdem wir das Massenwirkungsgesetz betrachten. Würde eine Reaktion vollständig ablaufen, wäre die Konzentration der Ausgangsstoffe “Null”. Da diese im Nenner des Massenwirkungsgesetzes stehen, wäre der Nenner “Null”. Rein mathematisch würden in diesem Fall eine Zahl durch “Null” teilen.
Im Rahmen der Allgemeinen Chemie können wir das Massenwirkungsgesetz dazu benutzen, um über das “Gleichgewicht” einer chemischen Reaktion eine Aussage treffen zu können, d.h. bildet sich bei einer chemischen Reaktion viel Produkt oder reagieren die Ausgangsstoffe eher kaum. Dazu gibt es drei Möglichkeiten:
Die sogenannte Gleichgewichtskonstante K des Massenwirkungsgesetzes ist
Diese drei Fälle sind idealisierte (Extrem)fälle, in der Realität liegt die “Gleichgewichtskonstante” zwischen diesen drei Fallen. Man spricht dann davon, dass das Gleichgewicht eher auf der Seite der Produkte (K > 1) bzw. eher auf der Seite der Ausgangsstoffe (K < 1) liegt.
Für besonders interessierte: Der sichere Umgang mit dem Massenwirkungsgesetz ist vor allem in der Anorganischen und der Physikalischen Chemie von enormer Bedeutung. Für viele quantitative Berechnungen von chemischen Reaktionen wird als Grundlage das Massenwirkungsgesetz verwendet. Beispiele für die Anwendung des Massenwirkungsgesetzes sind:
.
Das Massenwirkungsgesetz besagt, dass das Verhältnis der Konzentrationen von Produkten und Reaktanten, erhoben zu den entsprechenden stöchiometrischen Koeffizienten, bei konstanter Temperatur konstant ist.
Die Konstante K ist das Gleichgewichtskonstante und hängt von der Temperatur des Systems ab. Sie gibt das Verhältnis der Konzentration der Produkte und der Reaktanten an.
Die Gleichgewichtskonstante K ändert sich nur, wenn sich die Temperatur der Reaktion ändert.
Ein Katalysator hat keinen Einfluss auf das Gleichgewicht gemäß dem Massenwirkungsgesetz. Er beschleunigt jedoch sowohl die Hin- als auch die Rückreaktion, was zu einer schnelleren Einstellung des Gleichgewichts führt.
Eine Gleichgewichtskonstante K größer als 1 bedeutet, dass die Produkte bei der Reaktion bevorzugt werden. Es gibt also eine größere Konzentration der Produkte im Gleichgewicht.
Ändert man die Konzentration eines der Reaktanten oder Produkte, so verschiebt sich das Gleichgewicht gemäß dem Prinzip von Le Châtelier, um die Änderung auszugleichen und das Massenwirkungsverhältnis wiederherzustellen.
Das Massenwirkungsgesetz wird formal ausgedrückt, indem man die Konzentrationen der Produkte multipliziert und durch das Produkt der Konzentrationen der Reaktanten teilt, wobei jede Konzentration auf eine Potenz erhoben wird, die ihrem stöchiometrischen Koeffizienten entspricht.
Den Umkehrprozess des Massenwirkungsgesetzes nennt man Rückreaktion.
Wenn die Gleichgewichtskonstante K kleiner als 1 ist, bedeutet dies, dass die Reaktanten bei der Reaktion bevorzugt werden. Es gibt also eine größere Konzentration der Reaktanten im Gleichgewicht.
Eine Änderung des Drucks oder des Volumens kann gemäß dem Prinzip von Le Châtelier das Gleichgewicht verschieben, um die Änderung auszugleichen und das Massenwirkungsverhältnis wiederherzustellen.