Betrachtet man chemische Reaktionen bzw. Stoffumwandlungen, gibt es ein paar Gesetzmäßigkeiten, die dabei helfen, Fragestellungen im Bereich der Stoffumwandlungen zu lösen. Die wichtigsten Gesetzmäßigkeiten sind: Gesetz zur Erhaltung der Masse, Gesetz von den konstanten Proportionen und das Gesetz der multiplen Proportionen.
Ein eher physikalischer Lehrsatz ist der sog. Satz von Avogadro, der hilft, Gesetzmäßigkeiten von Gasen bei chemischen Reaktionen zu verstehen.
Die meisten Stoffe lassen sich durch Temperaturänderungen und/ oder Druckänderungen in die Aggregatzustände fest, flüssig oder gasförmig überführen. Für Verbindungen in allen Aggregatzuständen gelten die Gesetzmäßigkeiten von der Erhaltung der Masse und der konstanten/multiplen Proportionen in chemischen Reaktionen. Für Gase in chemischen Reaktionen gilt eine weitere Gesetzmäigkeit, der Satz von Avogadro.
Wird während einer Reaktion eine Verbindung (oder Element) erwärmt, so dehnt diese sich aus, egal ob Feststoff, Flüssigkeit oder Gas. Die Ausdehnung bei Feststoffen und Flüssigkeiten ist nicht vorhersagbar und die Volumenausdehnung ist für die Verbindungen unterschiedlich groß (dies lässt sich aufgrund der komplexen intermolekularen Wechselwirkungen wie z.B. Wasserstoffbrückenbindungen erklären).
Wie bereits erwähnt, ist die Volumenausdehnung bei Feststoffen und Flüssigkeiten nicht vorhersagbar. Bei Gasen ist dies anders, denn die Volumenzunahme beim Erwärmen ist für alle (idealen) Gase immer gleich groß.
Dies findet sich z.B. im Gasgesetz von Bolye und Marioette, dass besagt, dass eine Verdopplung des Drucks zu einer Halbierung des Volumens bei Gasen führt und dies bei allen Gasen gleich,
Satz von Avogadro:
Avogadro führte das Gasgesetz von Bolye und Marioette weiter und kam zu der Erkenntnis, dass alle Gase bei gleicher Temperatur und gleichem Druck ein gleichgroßes Volumen einnehmen. Daher müssen die Gase auch als gleich vielen Teilchen bestehen. Dies führte zu dem Satz von Avogadro:
Die obig genannten Gesetzmäßigkeiten lassen sich auch in physikalischen Größen ausdrücken. So beträgt das Volumen eines mols eines idealen Gases bei Normalbedingungen (0°C und 1013 hPa) 22,4 Liter und die Stoffmenge ” 1 mol” enthält 6,022 · 10-23 Teilchen. Beim Rechnen mit Gasen bei unterschiedlichen Temperaturen bzw. Drücken kann man zudem die Zustandsgleichung für Gase verwenden.
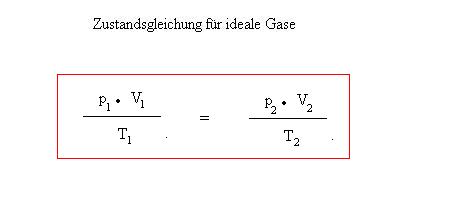
Zustandsgleichung
Zur Lösung dieser Aufgabe muss man die Temperatur von der Celsius-Skala in die Kelvin-Skala umrechnen, so sind z.B. 20°C -> (20 + 273) K. Anschließend löst man die Zustandsgleichung nach V2 auf. V2 = (p1 · V1· T2) : (T1 · p2) = 165 Liter.
In der Natur verhalten sich Gase nicht exakt nach dem einfachen Modell des idealen Gases,da die Gasteilchen eine Ausdehnung größer als null besitzen (reale Gasteilchen besitzen ein Eigenvolumen, werden nicht wie ein ideales Gas als Punkt betrachtet => das Volumen realer Gase größer ist als das Volumen eines idealen Gases). Zudem existieren zwischen den Teilchen realer Gase Wechselwirkungen, z.B. van-der-Waals-Wechselwirkung. Die Anziehungskräfte führen dazu, dass besonders bei einem hohen Druck der Gasdruck des realen Gases niedriger als der Druck des idealen Gases ist.
Der Satz von Avogadro besagt, dass gleichgroße Volumina von verschiedenen Gasen unter gleichen Bedingungen (Temperatur und Druck) die gleiche Anzahl von Molekülen enthalten.
Die stöchiometrische Beziehung bei Gasen ist eine Methode, um die Verhältnisse von reagierenden und resultierenden Molekülen bei einer chemischen Reaktion zu ermitteln. Es basiert auf dem Satz von Avogadro.
Das ideale Gasgesetz ist PV = nRT, wobei P der Druck ist, V das Volumen, n die Anzahl der Mole, R die ideale Gaskonstante und T die Temperatur in Kelvin.
Die Temperatur und der Druck sind direkt proportional zum Volumen eines idealen Gases, sofern die Molekülmenge konstant bleibt (dies wird als Gay-Lussac-Gesetz oder Amontonsches Gesetz bezeichnet).
Die molare Masse eines Gases kann bestimmt werden, indem man das Volumen, den Druck und die Temperatur des Gases misst und das ideale Gasgesetz verwendet.
Das Verhältnis der Gasmoleküle in einer Reaktionsgleichung wird oft durch die stöchiometrischen Koeffizienten repräsentiert, die auf den Satz von Avogadro zurückzuführen sind.
Das Molvolumen ist das Volumen eines Mols eines Gases bei Normbedingungen (0°C und 1 atm Druck). Es kann berechnet werden durch die Formel V = nRT/P.
Das molare Volumen eines Gases bei STP (Standardtemperatur und -druck) beträgt ungefähr 22,4 Liter pro Mol.
Der Satz von Avogadro ist wichtig für die Stöchiometrie, da er es erlaubt, das Verhältnis von Molekülen in einer Reaktion mit dem Verhältnis der Volumina von Gasen in einer Reaktion zu verknüpfen.
Stöchiometrie und Gasgesetze können helfen, die Menge an reagierendem Gas oder resultierendem Gas zu ermitteln, das bei einer chemischen Reaktion im gasförmigen Zustand vorhanden ist.