Molekulare Stoffe besitzen eine 3-dimensionale Gestalt, aus deren Information sich einige Eigenschaften ableiten lassen, beispielsweise ob eine Verbindung polar oder unpolar ist. Damit lässt sich beispielsweise die Wasserlöslichkeit einer Verbindung ableiten.
Woher bekommt man die Information über den räumlichen Bau, denn die Valenzstrichformel informiert nur über die Bindungen (bzw. Bindungsverhältnisse), gibt aber keine Information über den räumlichen Bau.
Das EPA (Elektronenpaarabstoßungsmodell) oder VSEPR-Modell (Valence Shell Electron Pair Repulsion, deutsch
Valenzschalen-Elektronenpaarabstoßungsmodell)
Die Grundregel des EPA-Modells besagt, dass sich Elektronenpaare so verhalten, als würden sie sich voneinander abstoßen und sich daher max. voneinander entfernt anordnen würden (größtmöglicher Winkel zueinander).
Dieses Modell wurde 1957 von Gillespie entwickelt, deswegen wird das EPA-Modell auch Gillespie-Modell genannt.
Im vorherigen Kapitel ist die Bestimmung der Geometrie für Moleküle mit Einfachbindungen erläutert worden, hier soll nun die Bestimmung der Geometrie erläutert werden, wenn ein Molekül mind. ein freies Elektronenpaar in seiner Struktur hat.
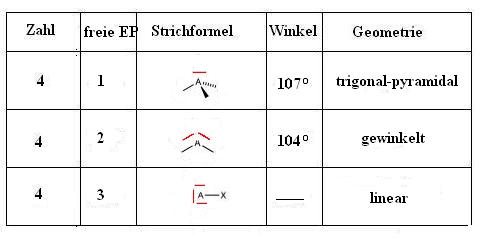
Übersicht über Molekülgeometrien
freie Elektronenpaare sind in der Grafik rot gekennzeichnet.
Nun könnte man sich fragen, warum ein Molekül mit 4 Elektronenpaaren (wovon 1 Elektronenpaar ein freies Elektronenpaar ist), nicht einen Bindungswinkel von 109° (wie z.B in CH4), sondern ein Winkel von 107°.
Bisher wurde beim EPA-Modell ausgegangen, dass sich alle Elektronenpaar (bindende oder freie) gleichmäßig weit voneinander abstoßen und so eine räumliche Geometrie erzeugen. Dies ist aber nicht korrekt, denn das Orbital eines freien Elektronenpaares nimmt einen größeren Raum in Anspruch als das Orbital eines bindenden Elektronenpaares (Wechselwirkung der Elektronen untereinander ist größer). Somit ist für die bindenden Elektronenpaare ein kleinerer Raum zur Verfügung, was den Winkel von 107° erklärt.
Die Abkürzung EPA steht für Elektronenpaarabstoßungs-Modell. Oft wird es auch als VESPR-Modell bezeichnet, wobei VESPR für “Valence Shell Electron Pair Repulsion” steht, was auf Deutsch Elektronenschalen-Elektronenpaarabstoßungs-Modell bedeutet.
Die Gestalt eines Moleküls wird nach dem VESPR-Modell von der Anzahl der Elektronenpaare in der Valenzschale des Zentralatoms bestimmt. Sowohl bindende als auch freie Elektronenpaare werden dabei berücksichtigt.
Freie Elektronenpaare üben eine stärkere Abstoßung auf die bindenden Elektronenpaare aus, was zu einer Verkleinerung der Bindungswinkel im Molekül führt.
Ein Wassermolekül hat die Struktur H2O. Es hat also 2 H-Atome und ein O-Atom im Zentrum. Im Falle von Wasser befinden sich auf dem Sauerstoffatom zwei bindende Elektronenpaare für die Bindungen zum Wasserstoff und zwei freie Elektronenpaare. Diese vier Elektronenpaare ordnen sich in einer tetraedrischen Anordnung um das Sauerstoffatom an. Aufgrund der stärkeren Abstoßung der freien Elektronenpaare gegenüber den bindenden ergeben sich die Winkel von 104.5° zwischen den Wasserstoff-Atomen.
Ein Methan-Molekül besteht aus einem Kohlenstoff-Atom im Zentrum, das mit vier Wasserstoff-Atomen verbunden ist. Da es keine freien Elektronenpaare gibt, ordnen sich die vier Bindungen in einem Tetraeder an. Die Winkel zwischen den Wasserstoff-Atomen betragen 109.5°.
Einige Moleküle sind nicht-planar wegen der Abstoßung von Elektronenpaaren in der Valenzebene. Sie arrangieren sich so, dass sie möglichst weit voneinander entfernt sind, um die Abstoßung zu minimieren. Dies führt zu einer dreidimensionalen, nicht-planaren Struktur.
Ammoniak besteht aus einem zentralen Stickstoffatom, das mit drei Wasserstoffatomen verbunden ist, und hat ein freies Elektronenpaar. Die Elektronenpaare ordnen sich in einer Tetraederstruktur an, aber aufgrund des freien Elektronenpaares wird die Raumstruktur von Ammoniak als pyramidal beschrieben.
Freie Elektronenpaare sind sehr wichtig in der Chemie, da sie an chemischen Reaktionen teilnehmen können. Sie sind verantwortlich für die Fähigkeit von Atomen, Verbindungen einzugehen und Moleküle zu bilden. Sie beeinflussen auch die räumliche Anordnung und Winkel in Molekülen.
Schwefelhexafluorid besteht aus einem Schwefelatom im Zentrum umgeben von sechs Fluoratomen. Da es keine freien Elektronenpaare gibt, ordnen sich die sechs Fluoratome in einer oktaedrischen Anordnung um das Schwefelatom. Die Bindungswinkel betragen 90° und die Raumstruktur ist oktaedrisch.
Das EPA-Modell wird verwendet, um die räumliche Anordnung von Atomen in einem Molekül und die daraus resultierenden Bindungswinkel zu erklären. Es ist wichtig in der Molekularbiologie, Medizin, Pharmazie und anderen Wissenschaften, die sich mit der Struktur und Funktion von Molekülen befassen.