Obwohl sich beide “chemischen” Größen ineinander umrechnen lassen, bezeichnen Löslichkeit und Löslichkeitsprodukt zwei unterschiedliche Tatsachen. Das Löslichkeitsprodukt beschreibt ein Gleichgewicht zwischen den Bodenkörper eines Stoffes und dessen gesättigte Lösung, das Löslichkeitsprodukt leitet sich direkt aus dem Massenwirkungsgesetz ab. Das Löslichkeitsprodukt beschreibt also eine Gleichgewichtsreaktion. Mit Hilfe des Löslichkeitsproduktes kann man die Konzentration gelöster Stoffe in einer Lösung bestimmen.
Der Begriff Löslichkeit bezeichnet die maximale Stoffmenge eines Stoffes, die sich bei bestimmten Reaktionsbedingungen (Druck und Temperatur) löst. Die Löslichkeit ist also nichts anders als die Konzentration einer gesättigten Lösung (und daher charakteristisch für jeden Stoff). Daher bezeichnet man im Chemieunterricht die beiden Begriffe (manchmal) anders. In diesem unterscheidet man zwischen dem Löslichkeitsprodukt und der sogenannten Sättigungskonzentration (ein anderer Begriff für Löslichkeit).
Das Löslichkeitsprodukt beschreibt die Gleichgewichtsreaktion eines gelösten Salzes mit seiner festen Phase. Daher lässt sich das Löslichkeitsprodukt auch aus dem sogenannten Massenwirkungsgesetz herleiten:
Leiten wir zuerst das Löslichkeitsprodukt für ein AB-Salz her, dazu nehmen wir Silberchlorid, dass schwerlöslich ist. Im ersten Schritt stellen wir die Reaktionsgleichung auf (Gleichgewichtsreaktion zwischen der festen Phase, dem Bodenkörper, und den gelösten Ionen)
Aus dieser Gleichgewichtsreaktion stellen wir nun das Massenwirkungsgesetz auf.
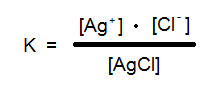
Die Konzentration von Silberchlorid entspricht der Sättigungskonzentration und ist daher eine Konstante, ebenfalls wie die Gleichgewichtskonstante. Daher bilden wir aus den beiden Konstanten eine neue Konstante und haben die Formel für das Lösilichkeitsprodukt:
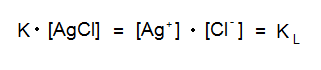
Genauso kann man das Löslichkeitsprodukt auch für andere Salz herleiten, allgemein lässt sich das Löslichkeitsprodukt folgendermaßen berechnen (für sogenannte AmBn-Salze)
AmBn <=> m·A n+ + n·B m-
KL = [A n+]m · [B m-]n
Wie eingangs beschrieben, gibt die Löslichkeit eines Stoffes, welche Menge an Stoff in einem Lösungsmittel gelöst werden kann. Nun wollen wir die Löslichkeit von (schwerlöslichem) Bariumsulfat berechnen. Dazu sehen wir nach dem Löslichkeitsprodukt von Bariumsulfat (beispielsweise in Wikipedia), so finden wir
KL (BaSO4) = 10-10 mol² /l²
Setzen wir dies nun in das Löslichkeitsprodukt ein, erhalten wir KL (BaSO4) = [Ba 2+] · [SO42-] = 10-10 mol² /l²
Da nun (aufgrund des sogenannten Elektroneutralitätsprinzips) die Konzentration (im Gleichgewicht) an Bariumionen und Sulfationen gleich sind, können wir die Gleichung vereinfachen:
Nun kann ich die Löslichkeit der Bariumionen bestimmen [Ba 2+]² = 10-10 mol² /l² => [Ba 2+] = 10-5 mol² /l² (Wurzel). Diese Konzentration an Bariumionen entspricht (im Gleichgewicht) auch der Sulfationen-Konzentration.
Hiermit kann man wissenschaftlich korrekt berechnen, ob ein schwerlösliches oder leichtlösliches Salz vorliegt
Genauso kann nun berechnet werden, ob eines ungesättigte oder gesättigte Salzlösung vorliegt:
Hinweis:
Das Löslichkeitsprodukt für fast alle Stoffe kann in diversen Lexika gefunden werden, allerdings sollte darauf geachtet werden, dass die Löslichkeit und damit auch das Löslichkeitsprodukt von der Temperatur abhängig ist (so steigt in der Regel mit zunehmender Temperatur die Löslichkeit von Salzen in Lösungsmittel). Daher sollte immer die Temperaturangabe betrachtet werden, für die die Löslichkeit bzw. das Löslichkeitsprodukt gilt.
Das Löslichkeitsprodukt ist eine spezielle Form des Gleichgewichtsprodukts und beschreibt die maximale Menge eines Salzes, die sich in einem gesättigten Zustand in einer bestimmten Menge Wasser lösen kann, bei einer bestimmten Temperatur.
Das Löslichkeitsprodukt ist temperaturabhängig, weil sowohl der Lösungsprozess als auch die Ausfällung exotherm oder endotherm sein können. Bei exothermen Prozessen nimmt die Löslichkeit mit steigender Temperatur ab, während sie bei endothermen Prozessen zunimmt.
Wenn das Löslichkeitsprodukt überschritten wird, ist die Lösung übersättigt und es kommt zu einer Ausfällung oder Kristallisation des überschüssigen Salzes.
Das Löslichkeitsprodukt bestimmt die maximale Löslichkeit eines Salzes in Wasser bei einer bestimmten Temperatur. Je größer das Löslichkeitsprodukt, desto höher ist die Löslichkeit des Salzes.
Die Löslichkeit von Salzen ist abhängig von ihren ionischen Bindungen. Salze mit stärkeren ionischen Bindungen haben tendenziell ein geringeres Löslichkeitsprodukt und sind daher weniger gut in Wasser löslich.
Das Prinzip der Le Chatelier besagt, dass ein chemisches System im Gleichgewicht, das von außen gestört wird, sich so anpasst, dass die Störung minimiert wird. Bei einer Änderung der Temperatur, des Drucks oder der Konzentration verlagert sich das Gleichgewicht hin zu dem Zustand, der diese Änderung vermindert.
Das Löslichkeitsprodukt eines Salzes kann berechnet werden, indem die Konzentrationen der Ionen in der gesättigten Lösung multipliziert und auf die Anzahl der Mole im Molekülverein genommen werden.
Eine gesättigte Lösung ist eine Lösung, in der die maximale Menge an Salz, die sich auflösen kann, bereits aufgelöst wurde und kein weiteres Salz mehr aufgenommen werden kann, bei einer bestimmten Temperatur.
Der Druck hat im Allgemeinen wenig Einfluss auf das Löslichkeitsprodukt solider Substanzen in Flüssigkeiten, kann jedoch die Löslichkeit von Gasen in Flüssigkeiten erheblich beeinflussen. Im Allgemeinen erhöht eine Erhöhung des Drucks die Löslichkeit von Gasen in Flüssigkeiten.
Das Löslichkeitsprodukt ist der konstante Wert, der die maximale Menge eines Salzes beschreibt, die sich in einer bestimmten Menge an Lösungsmittel auflösen kann, während die Löslichkeit die Menge des gelösten Salzes pro Volumeneinheit des Lösungsmittels ist.