Damit einzelne Atome in Molekülen die Edelgaskonfiguration erfüllen, bilden die Atome (des Moleküls) miteinander Atombindungen (kovalente Bindungen) aus. Dabei teilen sich zwei Atome ein gemeinsames Elektronenpaar. Teilen sich zwei Atome gemeinsam in einer Verbindung ein Elektronenpaar, so spricht man auch von einer Einfachbindung.
Zwei Atome in einer Verbindungen können aber auch mehr als ein Elektronenpaar gemeinsam teilen. In diesem Fall sprechen wir von einer Mehrfachbindung (Doppelbindung oder Dreifachbindung, wie beispielsweise die C=C- oder e C=O-Doppelbindung).
Doppelbindungen sind bei vielen Elementen möglich, die sich zu “Molekülen” verbinden. Stabile Dreifachbindungen sind aber nur bei Kohlenstoff und Stickstoff möglich (im Rahmen der Schulchemie). Daher beschränkt sich dieses Kapitel nur auf Einfachbindungen und Doppelbindungen. Da “Einfach- und Doppelbindungen” im Rahmen der Organischen Chemie vertieft werden, hier im Rahmen der Anorganischen Chemie die wichtigsten Aspekte von Doppel und Dreifachbindungen.
1. Wann liegt eine Mehrfachbindung vor?
Diese Frage lässt sich schnell beantworten, dazu muss man nur die Zahl der bindenden Elektronenpaare durch die Zahl der vorhandenen Atome (einer Verbindung) teilen. Nehmen wir hierzu als Beispiel die bekannte Verbindung Sauerstoffdioxid CO2,
Teilen wir nun die Anzahl der bindenden Elektronenpaare durch die 3 “Atomsorten” in der Verbindung CO2 erhalten wir 4 : 3 = 1,33 (> 1). Daher wissen wir, es liegt mindestens eine Mehrfachbindung vor.
2. Wie entsteht eine Einfachbindung und eine Doppelbindung?
Damit man die Bildung von Einfachbindungen und Doppelbindungen versteht, muss man das sogenannte Orbitalmodell verstanden haben und wie sich Wellenfunktionen überlagern. Daher nur (im Rahmen der Schulchemie) eine einfache Darstellung.
Eine Atombindung bzw. kovalente Bindung zwischen zwei Atomen (in einer Verbindung) bildet sich immer aus, wenn zwei Orbitale von zwei Atomen überlappen. Die Elektronen, die sich in diesen Orbitalen befinden, gehören beiden Atomen gemeinsam gehören.
Die sogenannte Elektronenkonfiguration eines Elements lässt sich aus den meisten Periodensystemen ablesen. Beispielsweise lautet die Elektronenkonfiguration für das Wasserstoffatom 1s1 (das Wasserstoffatom verfügt also über 1 Elektron im 1s-Orbital). Hierdurch kann man bereits begründen (ohne die Edelgaskonfiguration zu betrachten), warum Wasserstoff nur eine Einfachbindung ausbilden kann: es kann maximal nur mit einem s-Orbital mit einem Orbital eines anderen Atoms überlappen.
Elektronenkonfiguration eines Elements
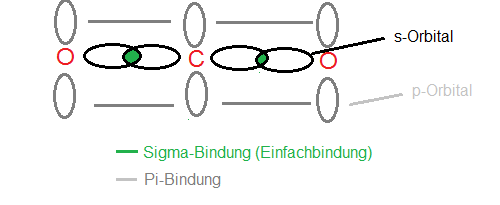
Gemäß der Überlappung der einzelnen Orbitale (s und p) bei Einfach- bzw. Doppelbindungen werden für diese Bindungen auch die Bezeichnungen Sigma- (Einfachbindung) und Pi-Bindung (Doppelbindung) verwendet, analog dem griechischen Alphabet.
3. Welche Eigenschaften zeigen Einfachbindung und Mehrfachbindung?
Oft hört man, dass Verbindungen mit einer Mehrfachbindung (Doppelbindung und Dreifachbindung) sehr elektronenreich und daher sehr reaktiv sind. Das viele Personen sich hierbei (nur) auf die Organische Chemie beziehen, zeigt sich an folgendem Beispiel: Das Stickstoff-Molekül besteht aus zwei Stickstoff-Atomen, die eine Dreifachbindung miteinander ausbilden. Die Stickstoff-Bindung in dem Molekül “Stickstoff” ist entsprechend elektronenreich, aber als (sehr) reaktiv würde niemand von uns den Stickstoff bezeichnen.
In der Organischen Chemie (also bei Kohlenstoffverbindungen) gilt diese in der Regel, je höher die sogenannte Bindungsordnung, desto reaktiver sind (vergleichbare) Verbindungen. So sind Alkene (mit mindestens einer Doppelbindung) reaktiver als Alkane (nur Einfachbindungen). Und Alkine (mit mindestens einer Dreifachbindung) sind reaktiver als vergleichbare Alkene.
Für Anorganische Verbindungen kann dies aber nicht als Regel verwendet werden. In diesem Fall kann nur ausgesagt werden (dies gilt ebenfalls für Organische Verbindungen)
Eine Sigma-Bindung ist die stärkste Art von Bindung, die aus dem direkten Überlappen der s-, p- und d-Orbitale entsteht. Es handelt sich dabei um die erste Bindung, die zwischen zwei Atomen auftritt. Eine Pi-Bindung ist schwächer und entsteht durch das Überlappen von nebengeordneten p-Orbitalen. Pi-Bindungen treten immer zusätzlich zu einer Sigma-Bindung auf.
Eine Einfachbindung besteht aus einer Sigma-Bindung und ist die einfachste Form der Bindung zwischen Atomen in einem Molekül.
Eine Doppelbindung besteht aus einer Sigma-Bindung und einer Pi-Bindung, was bedeutet, dass sie stärker ist als eine Einfachbindung, die nur eine Sigma-Bindung hat.
An einer Sigma-Bindung sind normalerweise zwei Elektronen beteiligt, ebenso wie an einer Pi-Bindung.
Die Sigma-Bindung kann aus dem Überlappen von s-, p- und d- Orbitalen entstehen.
Die Pi-Bindung entsteht durch das Überlappen von nebengeordneten p-Orbitalen.
Eine Doppelbindung ist kürzer als eine Einfachbindung, weil sie stärker ist – sie beinhaltet eine zusätzliche Pi-Bindung, was zu einer höheren Elektronendichte zwischen den Atomkernen führt.
Die Hauptrolle der Sigma-Bindung besteht darin, die Atome in einem Molekül zusammenzuhalten.
Die pi-Orbitale in einer Pi-Bindung liegen senkrecht zur Achse der molekularen Bindung und sind nebeneinander angeordnet.
Wenn eine Pi-Bindung gebrochen wird, bleibt eine einfachere Sigma-Bindung bestehen, und die Bindung zwischen den Atomen wird dadurch schwächer.