Dipolmoleküle (Dipole oder polare Moleküle) sind polare Verbindungen, bei denen sich die Schwerpunkte der negativen und positiven Partialladung gegenseitig nicht aufheben. Folgende Voraussetzungen sind dazu nötig:

Vorgehensweise
Mit Hilfe der Kenntnis der Polarität einer Verbindung lassen sich viele Materialeigenschaften ableiten. Die wichtigste Eigenschaft ist wohl, dass sich gleichartige Stoffe in gleichen lösen (z.B. polare Moleküle in polaren Molekülen). Somit lässt sich beispielsweise erklären, warum Ethanol (polares Molekül) wasserlöslich (Wasser ist ein polares Molekül) ist, während hingegen Benzin (unpolares Molekül) wasserunlöslich ist.
Wichtig:
Mithilfe dieses Verfahren lässt sich ableiten, warum Kohlenstoffdioxid ein unpolares Molekül ist (beide Vektoren heben sich auf). Zu beachten ist aber unbedingt die Geometrie von Molekülen, Wasser ist ein gewinkeltes Molekül (würde man es linear zeichnen, wäre es unpolar).
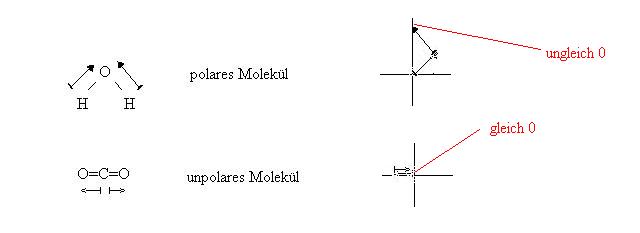
Ein Dipolmolekül ist ein Molekül, das polar ist, d.h., es hat eine positive und eine negative Ladung an gegenüberliegenden Enden aufgrund der ungleichen Elektronegativität der Atome.
Die Elektronegativität ist eine Messung dafür, wie stark ein Atom Elektronen in einer chemischen Bindung anzieht. In Dipolmolekülen zieht das elektronegativere Atom die Bindungselektronen stärker an, was zur Bildung einer polarisierten Bindung führt.
Eine Polare Bindung ist eine chemische Bindung, bei der ein Elektronenpaar ungleich zwischen den Atomen geteilt wird aufgrund der Unterschiede in ihrer Elektronegativität.
Nein, nicht alle Moleküle können Dipolmoleküle sein. Nur diejenigen mit ungleicher Elektronegativität und einer nicht symmetrischen Struktur können Dipolmoleküle bilden.
Ein Beispiel für ein Dipolmolekül ist Wasser (H2O). Das Sauerstoffatom zieht die Elektronen mehr an als die Wasserstoffatome, was das Molekül polar macht.
Ein Dipolmoment ist eine messbare Eigenschaft eines Dipolmoleküls, die die Ausrichtung und Stärke des Dipols darstellt.
Das Dipolmoment wird berechnet als Produkt aus Ladung und der Distanz zwischen den Ladungen.
Wenn ein Dipolmolekül in ein elektrisches Feld eingebracht wird, erwartet man, dass es sich ausrichtet, wobei die positive Seite zum negativen Feld und die negative Seite zum positiven Feld zeigt.
Ja, Dipolmoleküle können intermolekulare Kräfte bilden. Diese Kräfte sind als Dipol-Dipol-Wechselwirkungen bekannt und sind stärker als die von Nicht-Dipol-Molekülen.
Der Hauptunterschied zwischen einem Dipolmolekül und einem Nicht-Dipolmolekül besteht in ihrer Elektronegativität und ihrer Struktur. Ein Dipolmolekül hat ungleiche Elektronegativität und eine nicht-symmetrische Struktur, während ein Nicht-Dipol-Molekül entweder gleiche Elektronegativität oder eine symmetrische Struktur hat, die die Polarität aufhebt.