Molekulare Stoffe besitzen eine 3-dimensionale Gestalt, aus deren Information sich einige Eigenschaften ableiten lassen, beispielsweise ob eine Verbindung polar oder unpolar ist. Damit lässt sich beispielsweise die Wasserlöslichkeit einer Verbindung ableiten.
Woher bekommt man die Information über den räumlichen Bau, denn die Valenzstrichformel informiert nur über die Bindungen (bzw. Bindungsverhältnisse), gibt aber keine Information über den räumlichen Bau.
Der räumliche Bau eines Moleküls lässt sich ganz einfach mit einem einfachen Modell ableiten, unter der Annahme, dass Elektronen sich aufgrund ihrer gleichen Ladung (negative Ladung) möglichst weit voneinander abstoßen. Wichtig: Bei diesem Modell betrachtet man Bindungen (zwischen Atomen) und eine Bindung wird aus mind. zwei Elektronen aufgebaut.
Betrachtet man nun, wie sich 2 bzw. 3 Elektronenpaare max. weit entfernt voneinander abstossen können, kommt man zu folgenden Geometrien:
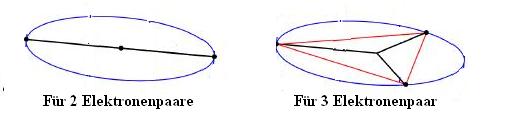
So liegen zwei Elektronenpaare einander gegenüber, linear auf einer Geraden (der Winkel zwischen den Bindungen beträgt 180°). Drei Elektronenpaare befinden sich planar auf den Ecken eines gleichseitigen Dreiecks (der Winkel zwischen den Bindungen beträgt 120°). So kann man i.d.R. auf die richtige Molekülgestalt schließen, da der Winkel zwischen den Bindungen immer max. sein sollte (Achtung: Ausnahmen), so ist 3 mal 120° besser als 1 mal 180° und 2 mal 90°.
Das EPA (Elektronenpaarabstoßungsmodell) oder VSEPR-Modell (Valence Shell Electron Pair Repulsion, deutsch
Valenzschalen-Elektronenpaarabstoßungsmodell)
Die Grundregel des EPA-Modells besagt, dass sich Elektronenpaare so verhalten, als würden sie sich voneinander abstoßen und sich daher max. voneinander entfernt anordnen würden (größtmöglicher Winkel zueinander).
Dieses Modell wurde 1957 von Gillespie entwickelt, deswegen wird das EPA-Modell auch Gillespie-Modell genannt.
Hier im ersten Kapitel sollen nur Moleküle betrachtet werden, die keine freien Elektronenpaare besitzen und nur Einfachbindungen besitzen:
1. Schritt: Man stellt die Valenzstrichformel auf, um herauszufinden, welches Atom das “Zentralatom” ist, und wie viele Bindungen von diesem Atom ausgehen.
2. Schritt: Ermitteln der Anzahl der Bindungen, die von diesem Zentralatom zu den Bindungspartnern ausgehen (Beispiel: CH4, C ist das Zentralatom mit 4 Bindungen zu den 4 H-Atomen).
3. Schritt: Auswahl des “Grundkörpers”, der der ermittelten Zahl aus dem 2.Schritt entspricht.
Das EPA-Modell oder VESPR-Modell (nach den englischen Anfangsbuchstaben von “Valence Shell Electron Pair Repulsion”) ist ein Modell aus der Chemie, das die räumliche Anordnung von Atomen in Molekülen erklärt. Es beruht auf der Abstoßung von Elektronenpaaren in der Valenzschale eines Atoms.
Das Grundprinzip des VESPR-Modells ist die Elektronenpaarabstoßung. Es wird davon ausgegangen, dass sich die Elektronenpaare in der äußeren Schale eines Atoms so anordnen, dass sie sich gegenseitig so wenig wie möglich abstoßen. Diese Anordnung bestimmt auch die räumliche Gestalt der Moleküle.
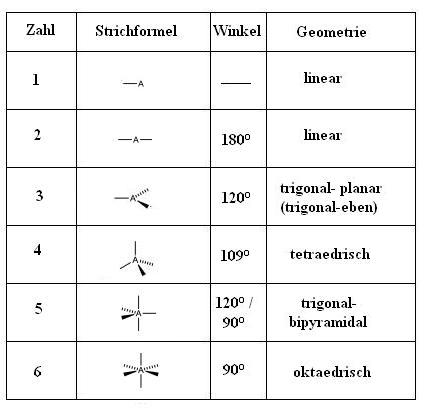
Die vier principalen Molekülgeometrien nach dem VESPR-Modell sind die lineare, trigonale, tetraedrische und oktaedrische Geometrie.
Das EPA-Modell bestimmt die räumliche Gestalt eines Moleküls auf Basis der Anzahl der Bindungs- und Nichtbindungselektronenpaare im Valenzschalenorbitale des Zentralatoms.
Für ein Molekül mit zwei Bindungspaaren und keinem Nichtbindungspaar ergibt sich nach dem EPA-Modell eine lineare Molekülgeometrie.
Für ein Molekül mit drei Bindungspaaren und keinem Nichtbindungspaar ergibt sich eine trigonale planare Molekülsgeometrie.
Für ein Molekül mit vier Bindungspaaren und keinem Nichtbindungspaar ergibt sich eine tetraedrische Molekülgeometrie.
Die molekulare Form beschreibt die Anordnung der Atome im Molekül, während die elektronische Geometrie die Anordnung der Elektronenpaare (sowohl Bindungs- als auch Nichtbindungselektronenpaare) um das Zentralatom beschreibt.
Nichtbindungselektronenpaare abstoßen sowohl sich selbst als auch die Bindungselektronenpaare stärker als diese sich gegenseitig. Dieser stärkere Abstoßungseffekt verschiebt die Bindungselektronenpaare und ändert so die Molekülform.
Nein, das EPA Modell ist ein vereinfachtes Modell und kann deshalb in manchen Fällen, insbesondere bei komplexeren Molekülen oder solchen mit d- und f-Orbitalen, ungenau sein.