Mehrprotonige Säuren wie beispielsweise Schwefelsäure oder Phosphorsäure können mehr als ein Proton abgeben. Die pH-Berechnung einer mehrprotonigen Säure ist relativ komplex und sollte daher in einzelne Dissoziationsstufen getrennt werden. Hierbei ist zu achten, ob beim Dissoziationsvorgang eine starke oder eine schwache Säure vorliegt.
pH-Berechnung einer mehrprotonigen Säure
Da die Protonenkonzentration einer mehrprotonigen Säure nicht der Ausgangskonzentration der Säure entspricht, müssen wir die Protonenkonzentration einer mehrprotonigen Säure (in wässriger Lösung) berechnen. Wie so oft (bei Gleichgewichtsreaktionen) verwenden wir hierzu das Massenwirkungsgesetz. Dazu betrachten wir uns eine zweiprotonige Säure
H2A + H2O <=> HA– + H3O+ (Gleichgewichtsreaktion mit der Konstante K1)
HA– + H2O <=> A- + H3O+ (Gleichgewichtsreaktion mit der Konstante K2)
Aus diesen beiden Reaktionsgleichungen stellen wir nun die beiden Massenwirkungsgesetze auf. Ausserdem wissen wir noch, die Protonen bei mehrprotonigen Säuren immer schrittweise erfolgt und die Protonenabgabe im zweiten Dissoziationsschritt gegenüber dem ersten deutlich erschwert ist.
Wollen wir nun den pH-Wert eines mehrprotonigen Säure berechnen, empfiehlt sich die pH-Wert-Berechnung schrittweise und nicht über komplizierte mathematische Formulierungen.
Betrachten wir die zweiprotonige Säure Schwefelsäure: Schwefelsäure kann zwei Protonen abgeben, daher Schwefelsäure auch zwei Dissoziationskonstanten K1 und K2 ( K1 = 10³ und K2 = 10-2).
Erste Dissoziationsstufe
Die erste Dissoziationskonstante von Schwefelsäure besagt, dass die “erste” Dissoziationsstufe von Schwefelsäure dem einer starken Säure entspricht ( K1 >> 1).
Dies bedeutet, dass im ersten Dissoziationsschritt alle Protonen vollständig abgegeben werden (aus H2SO4 wird HSO4 –). Die Konzentration an Protonen entspricht der Anfangskonzentration von Schwefelsäure.
Zweite Dissozisationsstufe
Die zweite Dissoziationskonstante von von Schwefelsäure besagt, dass die “zweite” Dissoziationsstufe von Schwefelsäure dem einer schwachen Säure entspricht ( K2 << 1). Wie bei einer schwachen Säure üblich, müssen wir (zur Berechnung der Protonenkonzentration im Gleichgewicht) das Massenwirkungsgesetz aufstellen:
K2 = ([H3O+] · [SO4 2-]) : HSO4–
zusätzlich wissen wir, dass die bereits vorhandene Protonenkonzentration der Konzentration der Schwefelsäure entspricht. Da wir die Sulfatkonzentration nicht kennen, bezeichnen wir diese mit “x”
K2 = ([H3O+] · x) : HSO4–
Die Protonenkonzentration in der zweiten Stufe entspricht der Anfangskonzentration der Schwefelsäure + der Konzentration an Sulfat-Ionen (Prinzip der Elektroneutralität, pro Sulfation entsteht ein Proton)
K2 = ([c(H2SO4)+ x] · x) : [c(H2SO4) – x]
aufgelöst
K2 · [c(H2SO4) – x] = x · c(H2SO4) + x²
nach x aufgelöst
x² + x · [K2 + c(H2SO4)] – K2 · c(H2SO4) = 0
Die nun folgende “Lösungsgleichung” zur pH-Wert Berechnung von mehrprotonigen Säuren (wobei der erste Dissoziationsschritt einer starken Säure entspricht) kennen wir aus den Formelsammlungen:
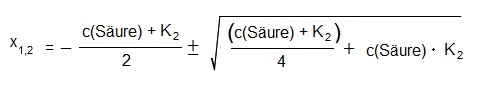
Hinweise
Bei der Berechnung des pH-Wertes der zweiprotonigen Säure sollte nicht vergessen werden, dass einige Näherungen zur Erstellung der Formel eingeflossen sind (z.B. Verdünnungseffekt wurde nicht betrachtet).
Nun kommt oft die Frage auf, wie “stark” ein zweiter Dissoziationsschritt bei der Protonenkonzentration beiträgt. Generell haben wir gesehen, dass im ersten Dissoziationschritt alle Protonen fast vollständig abgegeben wurden. Im zweiten Dissoziationsschritt liegt bereits eine schwache Säure vor (was uns der K2-Wert zeigt), weshalb diese kaum Protonen abgibt und somit zur Gesamtprotonenkonzentration kaum beiträgt.
Liegt bereits beim ersten Dissoziationschritt keine starke Säure vor, so gilt die obige Gleichung nicht und muss entsprechend dem obigen Schema hergeleitet werden.
Unter einer mehrprotonigen oder polyprotischen Säure versteht man eine Säure, die mehr als ein Proton (oder H⁺ Ionen) zur Lösung beisteuern kann. Beispiele sind Schwefelsäure (H₂SO₄) oder Phosphorsäure (H₃PO₄).
Die Schwefelsäure ist eine diprotische Säure, was bedeutet, dass sie zwei Protonen nacheinander abgeben kann, was zu unterschiedlichen pH-Werten führt.
Wenn man eine polyprotische Säure in Wasser gibt, findet eine stufenweise Dissoziation statt, in der jedes Wasserstoffion einzeln abgespalten wird, was jeweils zu einem anderen pH-Wert führt.
Die Berechnung des pH-Werts einer mehrprotonigen Säure geschieht häufig über die Säurekonstanten pKₐ-Werte und die jeweiligen Konzentrationen. Dabei wird jede einzelne Dissoziationsstufe berücksichtigt.
Der pKₐ-Wert ist ein Maß für die Säurestärke und gibt den pH-Wert an, bei dem die Konzentration des Acids und seines konjugierten Basenpaars gleich ist. Mehrprotonige Säuren haben mehrere pKₐ-Werte, einen für jede Dissoziationsstufe.
Monoprotische Säuren können nur ein H⁺ Ion abgeben und haben daher einen einzigen pH-Wert. Mehrprotonige Säuren können mehrere Protonen abgeben und haben daher mehrere pH-Werte.
Die pKₐ-Werte bei mehrprotonigen Säuren steigen typischerweise mit jeder Dissoziationsstufe. Das bedeutet, dass das erste abgespaltene H⁺ Ion eine stärkere Säurekraft hat als das zweite und so weiter.
Eine Möglichkeit ist die Darstellung durch ein Titrationsschema, in dem die Menge des zugegebenen Titrators gegen den pH-Wert aufgetragen wird. Man sieht dann für jede Dissoziation einen deutlichen Sprung im pH-Wert.
Der pH-Wert wird zur Messung der Säurestärke in Lösungen verwendet. In der Biologie spielt er eine wichtige Rolle in vielen Prozessen, da viele biologische Systeme (z.B. Blut) einen bestimmten pH-Wert aufrechterhalten müssen.
Die Säurekonstanten Kₐ1, Kₐ2, …, Kₐn bei mehrprotonigen Säuren geben die Gleichgewichtskonstanten für jede einzelne Dissoziation an. Wobei Kₐ1 für die erste, Kₐ2 für die zweite usw. Dissoziation stehen.